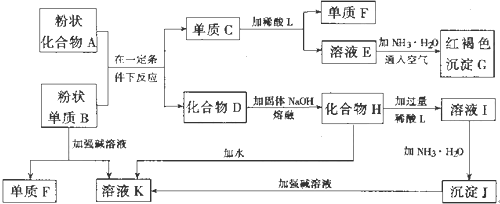
题目内容
19.下列分子的立体结构,其中属于直线型分子的是( )①H2O ②CO2 ③C2H2 ④P4 ⑤BeCl2 ⑥SO2.
| A. | ②③⑤ | B. | ②③⑤⑥ | C. | ②⑤⑥ | D. | ①② |
分析 根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构,据此判断.
解答 解:①H2O中O原子的价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,含有2个孤电子对,则分子空间构型是V型,故错误;
②CO2 中C原子的价层电子对个数=2+$\frac{1}{2}$×(4-2×2)=2,不含孤电子对,则分子空间构型是直线型,故正确;
③C2H2 中C原子形成2个σ键,不含孤电子对,则分子空间构型是直线型,故正确;
④P4 是正四面体型分子,故错误;
⑤BeCl2 中Be原子的价层电子对个数=2+$\frac{1}{2}$×(2-2×1)=2,不含孤电子对,则分子空间构型是直线型,故正确;
⑥SO2中S原子的价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3,含有1个孤电子对,则分子空间构型是V型,故错误.
故选A.
点评 本题考查了分子的立体构型的判断,侧重分子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子中原子的杂化及空间构型为解答的关键,题目难度中等.

练习册系列答案
相关题目
9.下列物质中既能发生加成也能发生取代反应且同时能使溴水因反应褪色,也能使高锰酸钾酸性溶液褪色的是( )
| A. | 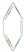 | B. | C6H14 | C. | 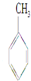 | D. |  |
10.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测得该物质属于离子化合物,且具有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性键 | |
| B. | K3C60中含有非极性共价键 | |
| C. | 1 mol K3C60中含有的阴离子个数为3×6.02×1023 | |
| D. | 该物质的化学式可写成KC20 |
7.甲烷的燃烧热890.3kJ•mol-1,1kg CH4在25℃,101kPa时充分燃烧生成液态水放出的热量约为( )
| A. | -5.56×104 kJ•mol1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
14.下列各能层中不包含p能级的是( )
| A. | N | B. | M | C. | L | D. | K |
4.化学与生产、生活密切相关.下列有关叙述正确的是( )
| A. | 泡沫灭火器中用的是苏打和硫酸铝 | |
| B. | 通过干馏可将煤中含有的苯、甲苯等物质分离出来 | |
| C. | 地沟油通过水解反应可得到车用汽油 | |
| D. | 家庭用洁厕灵与“84消毒液”不能同时使用 |
11. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
请回答下列问题.
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
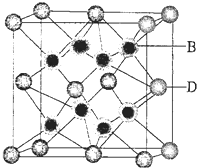
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
9.把质量为mg的铜丝灼烧变黑后,立即放入下列物质中,铜丝变红且质量不变的是( )
| A. | CH3COOH | B. | NaOH溶液 | C. | CH3CH2OH | D. | 稀HNO3 |