题目内容
10. 已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )
已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )| A. | A是镁,B是碳 | B. | A是碳,B是氢气 | C. | A是铝,B是铁 | D. | A是钠,B是氢 |
分析 C是单质且是绿色植物光合作用的产物之一,判断C是氧气,A、B是单质,与氧气反应,可推知X、Y是氧化物,然后结合元素化合物的性质采用代入法验证分析.
解答 解:C是单质且是绿色植物光合作用的产物之一,判断C是氧气,A、B是单质,与氧气反应,可推知X、Y是氧化物,A+X→B+Y属于置换反应,
A.A是镁.B是碳,镁和二氧化碳反应生成碳,镁和氧气反应生成氧化镁,C与氧气分别生成CO和二氧化碳,符合题意,故A不选;
B.如果A是碳,B是氢气,C与水反应生成CO和氢气,氢气与氧气反应生成水,C与氧气反应生成CO,符合题意,故B不选;
C.如果A是铝,B是铁,该反应为铝热反应,X是Fe2O3等、Y是Al2O3,反应为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+Fe,符合转化关系,故C不选;
D.如果A是钠,B是氢气,X应是H2O,Y是Na2O,而钠与水反应的方程式为2Na+2H2O=2NaOH+H2↑,生成的Y为NaOH,不符合题意,故D选,
故选D.
点评 本题考查物质推断、元素化合物性质等,难度不大,掌握元素化合物的性质是关键,注意利用代入验证法解答,有利于考查学生的发散思维以及总结归纳能力.

练习册系列答案
相关题目
1.配制100mL浓度为2mol/L NaOH溶液过程中,下列部分实验操作正确的是( )
| A. | 称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,并不断搅拌至固体溶解 | |
| B. | 称取8g NaOH固体,放入100 mL容量瓶中,加入蒸馏水使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8 g NaOH固体,放入100 mL量筒中,加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| D. | 称取8g NaOH固体放入烧杯中,加入适量蒸馏水溶解,冷却后将烧杯中溶液注入100 mL容量瓶后,用少量蒸馏水洗涤烧杯内壁2~3次 |
18.下列关于碱金属的叙述中不正确的是( )
| A. | 碱金属单质在化学反应中表现出强还原性 | |
| B. | Li 在氧气中燃烧主要生成Li2O2 | |
| C. | 碱金属离子的氧化性随着离子半径的增大而减小 | |
| D. | 随核电荷数的增加,单质与水反应剧烈程度增大 |
5.X、Y和Z是短周期元素组成的三种单质,X的组成元素是第三周期原子半径最大的元素;Y和Z均由元素R组成,Y由两个原子组成,R最外层电子数是内层电子数的3倍,下列推断正确的是( )
| A. | Y和Z互为同位素 | |
| B. | X和Y能化合成两种化合物 | |
| C. | X和Y化合的产物中一定不含有共价键 | |
| D. | X离子比R的离子半径大 |
15.已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是( )
| A. | Fe3+、F-、Cl- | B. | Mg2+、SO42-、Br- | C. | Mg2+、Cl-、Fe2+ | D. | Na+、NH4+、Cu2+ |
2.符号为N的能层最多能容纳的电子数是( )
| A. | 18 | B. | 32 | C. | 14 | D. | 15 |
20.某炔烃与足量的H2加成后的产物是 ,则原来的炔烃可能是( )
,则原来的炔烃可能是( )
 ,则原来的炔烃可能是( )
,则原来的炔烃可能是( )| A. | 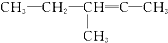 | B. |  | ||
| C. | 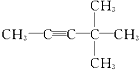 | D. | 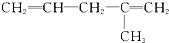 |
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.