��Ŀ����
����Ŀ�������Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ�ֻ�ѧԪ�أ��Իش��������⣺
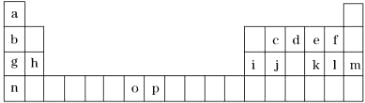
��1��Ԫ��oΪ25��Ԫ�أ���д�����̬ԭ�ӵĵ����Ų�ʽ______��
��2��d��a��Ӧ�IJ���ķ����У�����ԭ�ӵ��ӻ���ʽΪ______��
��3��d��e��f����Ԫ�صĵ縺�Դ�С˳��Ϊ����Ԫ�ط��ű�ʾ��_________________��
��4��o��p��Ԫ�صIJ��ֵ��������������±���

�Ƚ���Ԫ�ص�I2��I3��֪����̬o2+��ʧȥһ�����ӱ���̬p2+��ʧȥһ�������ѣ��Դˣ���Ľ�����______��
���𰸡� 1s22s22p63s23p63d54s2�� sp3�� F��O��N�� Mn2+��3d��������Ų�Ϊ����״̬���Ƚ��ȶ�
����������1��Ԫ��oΪ25��Ԫ�أ���MnԪ�أ����ݺ�������Ų����ɿ�֪���̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d54s2����2��d��a�ֱ���N��H��������Ӧ�IJ����ǰ���������ԭ�ӵ��ӻ���ʽΪsp3����3��ͬ�����������ҵ縺������ǿ����d��e��f����Ԫ�صĵ縺�Դ�С˳��ΪF��O��N����4������ Mn2+��3d��������Ų�Ϊ����״̬���Ƚ��ȶ���������̬Mn2+��ʧȥһ�����ӱ���̬Fe2+��ʧȥһ�������ѡ�

��ϰ��ϵ�д�
�����Ŀ




