题目内容
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?_______________________________________ 。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
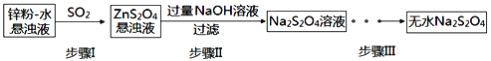
①步骤I中SO2表现了____________(填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________.
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:_________________
____HCOONa+____SO2+___Na2CO3===____Na2S2O4↓+___H2O+_________
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3 或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。 ____________________________.
【答案】 密封、阴凉处保存 氧化性 B 8 向漏斗中加少量无水乙醇至没过沉淀,滤干后重复操作2~3次 2HCOONa+4SO2+Na2CO3===2Na2S2O4+1H2O+3CO2 取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②(或取少许固体溶于水中,若闻到刺激性气味,则证明是②)
【解析】试题分析:(1)根据保险粉的性质:有极强的还原性,受热、遇水会发生分解反应,保险粉应密封、在阴凉处保存;
(2)①步骤I中锌是还原剂,则SO2是氧化剂,表现出氧化性;SO2气体易溶于水,并有较强的还原性,同时要考虑不能引入其他杂质气体。浓盐酸有挥发性,若选用浓盐酸则制得的SO2不纯,若选用稀硝酸,则SO2会被硝酸氧化,若选用稀硫酸,则反应速率较慢,且生成的SO2易溶于水,所以最合适的试剂是B。②根据Ksp[Zn(OH)2]=1.0×10-17,若ZnS2O4悬浊液中c(OH—)≥![]() =1.0×10-8,常温下,pH≥8,才能使Zn(OH)2沉淀完全;③根据保险粉不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。步骤Ⅲ中洗涤时,应该向漏斗中加少量无水乙醇至没过沉淀,滤干后重复操作2~3次;
=1.0×10-8,常温下,pH≥8,才能使Zn(OH)2沉淀完全;③根据保险粉不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。步骤Ⅲ中洗涤时,应该向漏斗中加少量无水乙醇至没过沉淀,滤干后重复操作2~3次;
(3)Na2S2O4中硫的化合价为+3价,由SO2生成Na2S2O4时硫元素化合价降低而被还原,则还原剂为HCOONa(碳的化合价为+2价),氧化产物为CO2,因此生成物中要补充CO2,然后根据质量守恒定律和得失电子守恒配平方程式,得:2HCOONa+4SO2+Na2CO3===2Na2S2O4+H2O+3CO2;
(4)比较①和②的区别,容易发现,不同的是②中生成物中存在SO42—,因此可以取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②。

