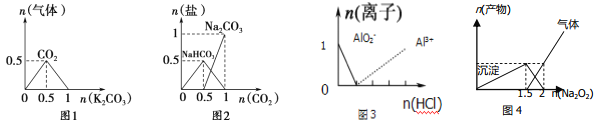题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是
A. 标准状况下,30.8gCCl4中所含的原子数为NA
B. 100g46%乙醇溶液中含有的H-O键的数目为NA
C. 1molNa2O2与足量的CO2充分反应,转移的电子数为NA
D. n(H2SO3)+n(HSO3-)=1mol的NaHSO3溶液中,含有Na+的数目大于NA
【答案】B
【解析】
A、30.8gCCl4的物质的量为![]() =0.2mol,含有原子1mol,所含的原子数为NA,故A正确;
=0.2mol,含有原子1mol,所含的原子数为NA,故A正确;
B、乙醇溶液中,除了乙醇中含有H-O键外,溶剂水中也含H-O键,而100g46%的乙醇溶液中含乙醇为1mol,故含H-O键数目为NA,含水为54g,物质的量为3mol,故含H-O键数目为6NA,则此溶液中共含7NA个H-O键,故B错误;
C、1mol Na2O2与足量CO2充分反应2Na2O2 +2CO2 = 2Na2CO3 + O2,只有过氧化钠中的O的化合价发生变化,转移的电子数为NA,故C正确;
D、HSO3-在溶液中既能部分水解为H2SO3又能部分电离为SO32-,故当n(H2SO3)+n(HSO3-)=1mol时,NaHSO3的物质的量大于1mol,则钠离子的个数多于NA个,故D正确;
故选B。

【题目】将一定量的SO2(g)和O2(g)通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到下表中的两组数据:下列说法正确的是( )
实验 编号 | 温度/℃ | 平衡常数 /mol﹣1L | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | K1 | 4 | 2 | x | 0.8 |
2 | T2 | K2 | 4 | 2 | 0.4 | y |
A. x=2.4,y=0.2 B. T1、T2的大小:T1<T2
C. K1、K2的大小:K1<K2 D. T1℃时,若起始量增倍,K1>K2
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。