题目内容
工业上常用铝质容器盛装冷浓酸。为研究铝质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将铝片放入氢氧化钠溶液中以除去表面氧化膜,反应的离子方程式为
(2)将已去除表面氧化物的铝片放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铝片表面无明显变化,其原因是 。
(3)另称取铝片6.0g放入15.0mL浓硫酸中,加热,充分应后收集到气体X 。甲同学取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量![]() 溶液,经适当操作后得干燥固体2.33g ,由于此推知气体X中
溶液,经适当操作后得干燥固体2.33g ,由于此推知气体X中![]() 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中![]() 体积分数的结果,丙同学认为气体X中还可能含量有
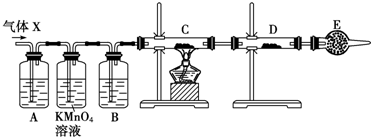
体积分数的结果,丙同学认为气体X中还可能含量有![]() 。为此设计了下列探究实验装置(图中夹持仪器省略)。
。为此设计了下列探究实验装置(图中夹持仪器省略)。

(1)丙同学认为还可能产生氢气的理由是_________________________________ _ 。
(2)A中试剂可选用( )
a.高锰酸钾溶液 b.品红溶液 c.氢氧化钠溶液 d.溴水
(3)B中加入的试剂可能是 ,E的作用是___________________ ;
(4)可以证明气体X中含有氢气的实验现象是:
________________________________________ _。
探究一:
.(1) Al2O3 + 2OH— = 2 AlO2—+ H2O (2) 铝表面被钝化 (3)50%
探究二:
(1) 随着反应的进行,浓硫酸逐渐变为稀硫酸,铝与稀硫酸反应产生氢气
(2) a,c,d
(3) 浓硫酸 防止空气中得水蒸气进入D装置中
(4) C中固体由黑变红和D中固体由白变蓝

 备战中考寒假系列答案
备战中考寒假系列答案