题目内容
工业上常用铝质容器盛装冷浓酸.为研究铝质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:[探究一]
(1)将铝片放入氢氧化钠溶液中以除去表面氧化膜,反应的离子方程式为
(2)将已去除表面氧化物的铝片放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铝片表面无明显变化,其原因是
(3)另称取铝片6.0g放入15.0mL浓硫酸中,加热,充分应后收集到气体X.甲同学取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图中夹持仪器省略).
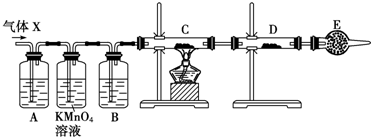
(1)丙同学认为还可能产生氢气的理由是
(2)A中试剂可选用
a.高锰酸钾溶液 b.品红溶液 c.氢氧化钠溶液 d.溴水
(3)B中加入的试剂可能是
(4)可以证明气体X中含有氢气的实验现象是:
分析:[探究一]
(1)铝片表面氧化膜为氧化物,氧化铝为两性氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水;
(2)常温条件下,铝与浓硫酸能产生钝化现象;
(3)双氧水将二氧化硫氧化成硫酸,2.33g白色沉淀为硫酸钡,根据原子守恒计算出二氧化硫的物质的量,再计算出二氧化硫的体积分数;
[探究二]
(1)浓硫酸变成稀硫酸,稀硫酸与金属铝反应生成氢气;
(2)根据实验目的是检验二氧化硫中混有氢气,所以装置A的作用是将二氧化硫除去,据此进行判断合理的试剂;
(3)利用氢气的还原性检验混合气体中含有氢气,将氢气通入装置C前必须进行干燥,避免大试管炸裂;装置E作用是防止空气中的水分进入装置D,避免干扰氢气的检验;
(4)氢气与氧化铜反应生成金属铜和水蒸气,如果混合气体中含有氢气,则黑色氧化铜变成红色铜,且D中固体变蓝.
(1)铝片表面氧化膜为氧化物,氧化铝为两性氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水;
(2)常温条件下,铝与浓硫酸能产生钝化现象;
(3)双氧水将二氧化硫氧化成硫酸,2.33g白色沉淀为硫酸钡,根据原子守恒计算出二氧化硫的物质的量,再计算出二氧化硫的体积分数;
[探究二]
(1)浓硫酸变成稀硫酸,稀硫酸与金属铝反应生成氢气;
(2)根据实验目的是检验二氧化硫中混有氢气,所以装置A的作用是将二氧化硫除去,据此进行判断合理的试剂;
(3)利用氢气的还原性检验混合气体中含有氢气,将氢气通入装置C前必须进行干燥,避免大试管炸裂;装置E作用是防止空气中的水分进入装置D,避免干扰氢气的检验;
(4)氢气与氧化铜反应生成金属铜和水蒸气,如果混合气体中含有氢气,则黑色氧化铜变成红色铜,且D中固体变蓝.
解答:解:[探究一]
(1)铝片表明生成氧化铝保护膜,最终了金属铝继续被氧化,可以用氢氧化钠溶液除去铝表明的氧化铝,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)铝片放入冷硫酸中,浓硫酸有较强的氧化性能使铝片钝化阻止反应进一步进行,
故答案为:铝表面被钝化;
(3)SO2具有还原性,通入足量双氧水中,SO2被氧化成H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)=
=0.02mol;
SO2 ~BaSO4
1mol 233g
n 2.33g
n=0.01mol
所以二氧化硫的体积分数为:
×100%=50%,
故答案为:50%;
[探究二]
(1)由于随着反应的进行,浓硫酸会逐渐变为稀硫酸,金属铝能够与稀硫酸反应产生氢气,
故答案为:随着反应的进行,浓硫酸逐渐变为稀硫酸,铝与稀硫酸反应产生氢气;
(2)装置A中的试剂必须能够将二氧化硫气体除去,选用试剂可以为酸性高锰酸钾溶液、氢氧化钠溶液、溴水;品红试液可以检验二氧化硫,但是不能用于除去二氧化硫,所以正确的是acd,
故答案为:acd;
(3)装置B中盛放的是浓硫酸,用于干燥除去二氧化硫的后的气体,防止气体中的水蒸气加入装置C导致大试管断裂;装置D用于检验反应产物是否有水分生成,所以必须使用碱石灰吸收空气中的水蒸气,防止空气中得水蒸气进入D装置中干扰氢气的检验,
故答案为:浓硫酸;防止空气中得水蒸气进入D装置中;
(4)如果混合气体中含有氢气,则C中固体CuO由黑变红,同时装置D中无水硫酸铜固体由白变蓝,
故答案为:C中固体由黑变红和D中固体由白变蓝.
(1)铝片表明生成氧化铝保护膜,最终了金属铝继续被氧化,可以用氢氧化钠溶液除去铝表明的氧化铝,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)铝片放入冷硫酸中,浓硫酸有较强的氧化性能使铝片钝化阻止反应进一步进行,
故答案为:铝表面被钝化;
(3)SO2具有还原性,通入足量双氧水中,SO2被氧化成H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)=
| 0.448L |
| 22.4L/mol |
SO2 ~BaSO4
1mol 233g
n 2.33g
n=0.01mol
所以二氧化硫的体积分数为:
| 0.01mol |
| 0.02mol |
故答案为:50%;
[探究二]
(1)由于随着反应的进行,浓硫酸会逐渐变为稀硫酸,金属铝能够与稀硫酸反应产生氢气,
故答案为:随着反应的进行,浓硫酸逐渐变为稀硫酸,铝与稀硫酸反应产生氢气;
(2)装置A中的试剂必须能够将二氧化硫气体除去,选用试剂可以为酸性高锰酸钾溶液、氢氧化钠溶液、溴水;品红试液可以检验二氧化硫,但是不能用于除去二氧化硫,所以正确的是acd,
故答案为:acd;
(3)装置B中盛放的是浓硫酸,用于干燥除去二氧化硫的后的气体,防止气体中的水蒸气加入装置C导致大试管断裂;装置D用于检验反应产物是否有水分生成,所以必须使用碱石灰吸收空气中的水蒸气,防止空气中得水蒸气进入D装置中干扰氢气的检验,
故答案为:浓硫酸;防止空气中得水蒸气进入D装置中;
(4)如果混合气体中含有氢气,则C中固体CuO由黑变红,同时装置D中无水硫酸铜固体由白变蓝,
故答案为:C中固体由黑变红和D中固体由白变蓝.
点评:本题考查了金属铝及其化合物性质、浓硫酸的性质、常见气体的检验,题目难度中等,注意掌握铝及其化合物的性质、浓硫酸的化学性质,明确常见气体的性质及检验方法.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
