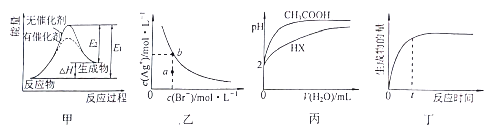
题目内容
【题目】根据下列四种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.S和U B.S和T C.T和U D.R和T E.R和U
(2)T的氯化物的化学式为___________________
(3)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_________,其中元素_______的第一电离能反常高的原因是_____________。
【答案】 E TCl3 10 R<S<T S S元素的最外层电子处于s能级全满,能量较低,比较稳定,失去一个电子吸收的能量较多
【解析】试题分析:本题考查电离能的分析和电离能的应用。R的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,R的第二电离能远大于第一电离能,R原子的最外层有1个电子;S的各级电离能:I1
I4,R的第二电离能远大于第一电离能,R原子的最外层有1个电子;S的各级电离能:I1![]() I2
I2![]() I4,S的第三电离能远大于第二电离能,S原子的最外层有2个电子;T的各级电离能:I1
I4,S的第三电离能远大于第二电离能,S原子的最外层有2个电子;T的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,T的第四电离能远大于第三电离能,T原子的最外层有3个电子;U的各级电离能:I1
I4,T的第四电离能远大于第三电离能,T原子的最外层有3个电子;U的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,U的第二电离能远大于第一电离能,U原子的最外层有1个电子。
I4,U的第二电离能远大于第一电离能,U原子的最外层有1个电子。
(1)根据上述分析,R原子和U原子的最外层有1个电子,最可能都处于IA族,最可能处于同一族的是R和U,答案选E。
(2)T原子的最外层有3个电子,T的化合价为+3价,T的氯化物的化学式为TCl3。
(3)根据上述分析,U的第1次电离能飞跃是失去第2个电子,U是短周期元素,估计U的第2次电离能飞跃是失去第10个电子时发生。
(4)若R、S、T是同周期的三种主族元素,R的最外层电子数为1,R位于第IA族,S的最外层电子数为2,S位于第IIA族,T的最外层电子数为3,T位于IIIA族,它们的原子序数由小到大的顺序为R![]() S
S![]() T。其中元素S的第一电离能反常的高,原因是:S的价电子排布式为ns2,S元素的最外层的s能级为全充满,能量较低,比较稳定,失去一个电子吸收的能量较多。
T。其中元素S的第一电离能反常的高,原因是:S的价电子排布式为ns2,S元素的最外层的s能级为全充满,能量较低,比较稳定,失去一个电子吸收的能量较多。
点睛:解答本题的关键是理解各级电离能与元素原子的最外层电子数之间的关系,如果某元素的In+1In,该元素原子的最外层电子数为n。知道同一周期中第IIA族、第VA族元素的第一电离能大于相邻元素的原因。
【题型】填空题
【结束】
20
【题目】有原子序数依次增大的A、B、C、D、E、F、G七种元素,A元素的原子是周期表中半径最小的原子,B原子最外层电子数是次外层电子数的1.5倍,元素C在自然界中形成物质种类最多,E、F、G三种元素原子的质子数之和为62,E元素原子2p轨道上有两个未成对电子,G元素原子4p轨道上有1个未成对电子,且它的阴离子具有跟氪相同的电子层结构,E、F、G能够形成多种常见的盐。请回答下列问题:
(1)E元素原子的价层电子的电子排布图为________;F元素原子基态时的电子排布式:______,E、F形成的化合物之一能够与水反应放出气体,写出该化合物与水反应的离子方程式:______。
(2)B、D、F均可与G形成化合物
①用电子式表示F、G形成的化合物的过程:__________。
②BG3和DG3中心原子的杂化方式分别为__________和____________。电负性大小关系为B____D;第一电离能介于B和D之间的第二周期元素有________种。
(3)C、E能形成两种常见的化合物,根据等电子原理,写出CE分子的结构式____。
(4)由A、C、E形成的气态化合物X,其分子的空间构型是___;1 molX分子中σ键的数目为____;X可被催化氧化,该反应的催化剂含有Cu、Zn、Ag、Fe等元素。基态Fe原子的电子排布了____________个能级,有_________个运动状态,在周期表中在_______区。向黄色FeCl3溶液中加入无色KSCN溶液,溶液变成红色。该反应在有的教材中用方程式FeCl3+3KSCN==Fe(SCN)3+3KCl表示。生成物中KCl既不是难溶物、难电离的物质,也不是易挥发物质,该反应之所以能进行的原因是___________。经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。
①所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显红色。该配合物离子的化学式是__________________。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为___________。
【答案】 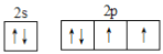 1s22s22p63s23p64s1 2K2O2+2H2O=4K++4OH-+O2↑
1s22s22p63s23p64s1 2K2O2+2H2O=4K++4OH-+O2↑ ![]() sp2 sp3 < 3 C
sp2 sp3 < 3 C![]() O(或C
O(或C![]() O) 平面三角形 3NA 7 26 d Fe(SCN)3是难电离物质 [Fe(SCN)]2+ FeCl3+5KSCN==K2[Fe(SCN)3]+3KCl
O) 平面三角形 3NA 7 26 d Fe(SCN)3是难电离物质 [Fe(SCN)]2+ FeCl3+5KSCN==K2[Fe(SCN)3]+3KCl
【解析】试题分析:本题考查物质的结构与性质,涉及元素的推断、价电子排布图和核外电子排布式的书写、第一电离能和电负性大小的比较、离子方程式和电子式的书写、杂化方式和分子空间构型的判断、等电子原理、配合物的形成等。A元素的原子是周期表中半径最小的原子,A为H元素;B原子最外层电子数是次外层电子数的1.5倍,B为B元素;元素C在自然界中形成物质种类最多,C为C元素;E的原子序数大于C,E元素原子2p轨道上有两个未成对电子,E为O元素;D的原子序数介于C和E之间,D为N元素;G元素原子4p轨道上有1个未成对电子,其价电子排布可能为4s24p1或4s24p5,G的阴离子具有跟氪相同的电子层结构,G为Br元素;E、F、G三种元素原子的质子数之和为62,F的质子数为62-8-35=19,F为K元素。
(1)E为O元素,基态O原子的核外电子排布式为1s22s22p4,价电子排布图为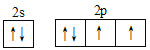 。F为K元素,根据构造原理,基态K原子的核外电子排布式为1s22s22p63s23p64s1。O与K形成的能够与水反应放出气体的化合物为K2O2,K2O2与水反应的离子方程式为2K2O2+2H2O=4K++4OH-+O2↑。
。F为K元素,根据构造原理,基态K原子的核外电子排布式为1s22s22p63s23p64s1。O与K形成的能够与水反应放出气体的化合物为K2O2,K2O2与水反应的离子方程式为2K2O2+2H2O=4K++4OH-+O2↑。
(2)①F为K元素,G为Br元素,K与Br形成的化合物为KBr,KBr的形成过程用电子式表示为![]() 。
。
②BG3为BBr3,中心原子B上的孤电子对数为![]() (3-3
(3-3![]() 1)=0,B的价层电子对数为0+3=3,B原子的杂化方式为sp2杂化。DG3为NBr3,中心原子N上的孤电子对数为
1)=0,B的价层电子对数为0+3=3,B原子的杂化方式为sp2杂化。DG3为NBr3,中心原子N上的孤电子对数为![]() (5-3
(5-3![]() 1)=1,N的价层电子对数为1+3=4,N原子的杂化方式为sp3杂化。非金属性B
1)=1,N的价层电子对数为1+3=4,N原子的杂化方式为sp3杂化。非金属性B![]() N,电负性B(B)
N,电负性B(B)D(N)。B和N都是第二周期元素,第二周期元素中第一电离能介于B和N之间的有Be、C、O,有3种。
(3)C为C,E为O,C与O形成的常见化合物有CO、CO2,根据等电子原理,CO与N2互为等电子体,N2的结构式为N![]() N,则CO的结构式为C
N,则CO的结构式为C![]() O(或C
O(或C![]() O)。
O)。
(4)由A、C、E形成的气态化合物X为HCHO,HCHO中C原子为sp2杂化,HCHO分子的空间构型为平面三角形。HCHO中含2个C-H键、1个C=O键,单键全为σ键,双键中含1个σ键和1个π键,1molHCHO分子中含3molσ键,即1molX中σ键的数目为3NA。Fe的原子序数为26,Fe原子核外有26个电子,根据构造原理,基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,排布了1s、2s、2p、3s、3p、3d、4s能级,共7个能级。原子核外各电子的运动状态都不相同,有26个运动状态。由于最后的6个电子填入3d能级,Fe在周期表中的d区。KCl既不是难溶物、难电离的物质,也不是易挥发物质,反应“FeCl3+3KSCN=Fe(SCN)3+3KCl”能进行的原因是:Fe(SCN)3是难电离物质。
①Fe3+带3个单位正电荷,SCN- 带一个单位负电荷,配离子所带电荷数等于中心离子和配体总电荷的代数和,则Fe3+与SCN-以个数比1:1形成的配离子带2个单位正电荷,该配合物离子的化学式为[Fe(SCN)]2+。
②若Fe3+与SCN-以个数比1:5配合,则形成的配合物离子的化学式为[Fe(SCN)5]2-,反应的化学方程式为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:i. 氨基甲酸铵:白色固体,易分解,易水解;甘氨酸亚铁:易溶于水,难溶于乙醇。
ii. 甘氨酸:易溶于水,微溶于乙醇,两性化合物。
iii. 柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
I.制备氨基甲酸铵:反应的化学方程式为:2NH3(g)+CO2(g) ![]() NH2COONH4(g) △H<0
NH2COONH4(g) △H<0
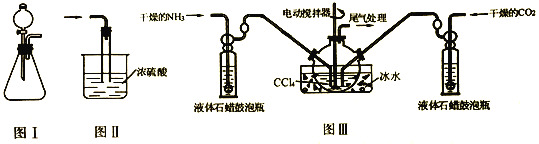
(1)图Ⅰ装置制备NH3,则所选试剂为_________________
(2)图Ⅲ装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是_______________(填操作名称)
②图Ⅱ装置进行尾气处理,则双通玻璃管的作用________________
③液体石蜡鼓泡瓶的作用是________________
④发生器用冰水冷却的原因是________________
II.制备(NH2CH2COO)2Fe:装置如图(夹持和加热仪器已省略), 用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
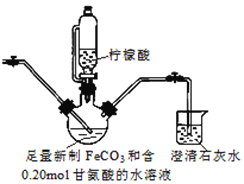
(3)烧杯中澄清石灰水的作用是_______________。
(4)柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析pH过低使产率下降的原因是___________;柠檬酸的作用还有_____(填序号)。
a.作反应终点指示剂 b.防止二价铁被氧化 c. 作催化剂 d. 促进FeCO3溶解
(5)乙醇的作用是________________。
(6)若产品的质量为m g,则产率为________________。