题目内容
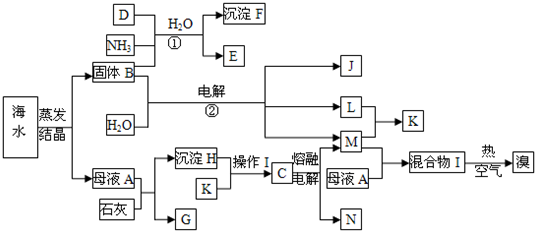
试填写下列空白:
(1)写出反应①②的化学方程式
(2)由沉淀H与K反应得到的溶液中如何得到纯净的C固体?
(3)在工业上反应②主要采用离子交换膜法,下列关于离子交换膜电解槽的叙述错误的是
A.精制饱和固体B溶液进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气D.电解槽的阳极用金属铁网制成
(4)工业上制取单质溴,通常是向混合物I中通入热的空气再用SO2吸收,然后经过氯化、蒸馏、分液等操作,简述工业上为什么不用CCl4萃取的方法得到单质溴?
(2)根据流程图知氢氧化镁H,盐酸K,C为无水MgCl2 固体,镁离子会水解,据此解答;
(3)工业上反应②为电解饱和食盐水,根据离子交换膜电解槽的工作原理解答;
(4)从用CCl4萃取法的工艺的效率,消耗能源多少,成本角度考虑.
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaCl+2H2O
| ||
(2)氢氧化钙与母液中的镁离子反应生成氢氧化镁H,氢氧化镁与盐酸K反应得到氯化镁,镁离子会水解,须在HCl气体中进行蒸发、结晶、干燥制得纯净的无水MgCl2 固体,从而电解熔融状态的氯化镁得到镁单质N,
故答案为:沉淀H与K反应得到MgCl2溶液必须在HCl气体中进行蒸发、结晶、干燥制得纯净的固体MgCl2;
(3)工业上反应②为电解饱和食盐水,电解饱和氯化钠溶液,能生成氢氧化钠、氯气和氢气,
A.根据电解的工作原理:阳极放电的是氯离子,生成氯气,阴极放电的是氢离子,生成氢气,氢氧根和钠离子结合生成氢氧化钠,精制饱和固体B溶液,进入阳极室为氯离子,故A正确;
B.阴极放电的是氢离子,生成氢气,氢氧根和钠离子结合生成氢氧化钠,所以进入阴极室的是水,故B正确;
C.根据电解的工作原理:阴极放电的是氢离子,生成氢气,氢氧根和钠离子结合生成氢氧化钠,故C正确;
D.根据电解原理,当阳极为金属铁时,电解时,铁优先失去电子,所以电解槽的阳极用金属铁网制成,阳极是铁失去电子,不是氯离子失去电子,得不到氯气,故D错误;
故答案为:D;
(4)工业上制取单质溴,氯化后的海水虽然含有溴单质,但浓度低,产量低,经过“空气吹出、SO2吸收、氯化”的过程进行富集,然后蒸馏、分液得到单质溴,如果用CCl4萃取,须投资设备,增加成本,且会产生环境污染,
答:用CCl4萃取法的工艺复杂、设备投资大、经济效益低、环境污染严重.

Ⅰ某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,由图中数据分析求:
|
|
(1)该反应的化学方程式为_______________。
(2)反应开始至4 min时,A的平均反应速率为________。
(3)第4min末时A、B的物质的量浓度依次为____________ 、________ 。
第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
Ⅱ碘在海水中主要以![]() 的形式存在,而在地壳中主要以
的形式存在,而在地壳中主要以![]() 的形式存在,几种粒子之间有如下转化关系:
的形式存在,几种粒子之间有如下转化关系:
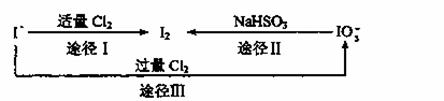
①途径Ⅰ反应的离子方程式是________________________。
②如以海水为原料制取I2,通入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,则途径Ⅲ的反应中氧化剂和还原剂物质的量之比是________________________。
③如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是________________________________。
Ⅰ某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,由图中数据分析求:
|
|
(1)该反应的化学方程式为_______________。
(2)反应开始至4 min时,A的平均反应速率为________。
(3)第4min末时A、B的物质的量浓度依次为____________ 、________ 。
第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
Ⅱ碘在海水中主要以![]() 的形式存在,而在地壳中主要以
的形式存在,而在地壳中主要以![]() 的形式存在,几种粒子之间有如下转化关系:
的形式存在,几种粒子之间有如下转化关系:

①途径Ⅰ反应的离子方程式是________________________。
②如以海水为原料制取I2,通入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,则途径Ⅲ的反应中氧化剂和还原剂物质的量之比是________________________。
③如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是________________________________。





