题目内容
4.下列现象或事实不能用同一原理解释的是( )| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | 硫化钠和硫酸亚铁固体长期暴露在空气中变质 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |
分析 A.浓硝酸见光易分解;氯水见光会分解;
B.硫化钠具有还原性,易被空气中的氧气氧化而变质;亚硫酸钠具有还原性,易被空气中的氧气氧化而变质;
C.常温下铁遇浓硝酸,发生钝化;铂的活泼性较弱,与浓硝酸不反应;
D.MnO2或FeCl3为过氧化氢分解的催化剂.
解答 解:A.浓硝酸见光易分解,须存放在棕色瓶中;氯水见光会分解,应盛放在棕色瓶中,能用同一原理解释,故A不选;
B.硫化钠具有还原性,易被空气中的氧气氧化而变质;亚硫酸钠具有还原性,易被空气中的氧气氧化而变质,能用同一原理解释,故B不选;
C.常温下铁遇浓硝酸,发生钝化;铂的活泼性较弱,与浓硝酸不反应,不能用同一原理解释,故C选;
D.MnO2或FeCl3为过氧化氢分解的催化剂,可增大反应速率,故D不选.
故选C.
点评 本题考查元素化合物知识,为高频考点,侧重分析与应用能力的考查,题目难度不大,注意把握物质的性质的异同.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
15.常温下,下列各组离在指定的溶液中一定能大量共存的是( )
| A. | 无色酸性溶液中:Al3+、Cl-、Fe3+、SO42- | |
| B. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、NO3- | |
| C. | 0.1mol•L-1NaHCO3溶液中:K+、AlO2-、Cl-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe3+、Ca2+、NO3-、Cl- |
19.在容积为2L的容器内,发生反应2A(s)+3B(g)?2C(g)+D(g),△H<0起始时充入3molA和2.5molB混合气体,经过5min生成0.5molD,下列说法正确的是( )
| A. | B的平均消耗速率为0.3mol/(L•min) | |
| B. | 升高温度时,v正减小,v逆增大 | |
| C. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| D. | 平衡后,增大压强,平衡将向正方向移动 |
16.除去CO2、Cl2 中少量HCl气体,可依次选用( )
| A. | 饱和石灰水、NaOH溶液 | B. | Na2CO3溶液、AgNO3溶液 | ||
| C. | NaHCO3溶液、饱和食盐水 | D. | 氨水、石灰水 |
13.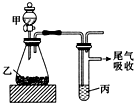 用如图装置进行实验,下列所得结论正确的是( )
用如图装置进行实验,下列所得结论正确的是( )
 用如图装置进行实验,下列所得结论正确的是( )
用如图装置进行实验,下列所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| A. | A | B. | B | C. | C | D. | D |
14.下列化学用语表示正确的是( )
| A. | Cl-的结构示意图: | |
| B. | 聚丙烯的结构简式: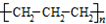 | |
| C. | 三氟化氮的电子式: | |
| D. | 熔融硫酸氢钾电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |