题目内容
13.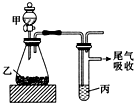 用如图装置进行实验,下列所得结论正确的是( )
用如图装置进行实验,下列所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与苯酚钠溶液反应;
B.硫化氢与溴发生氧化还原反应,但不能比较Cl-、Br-的还原性;
C.根据氧化剂氧化性大于氧化产物的氧化性比较;
D.分别发生复分解反应和加成反应,不能比较稳定性.
解答 解:A.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与苯酚钠溶液反应,则该实验不能比较H2CO3、苯酚的酸性,故A错误;
B.硫化氢与溴发生氧化还原反应,没有涉及Cl-、Br-的还原性比较,不能比较Cl-、Br-的还原性,故B错误;
C.高锰酸钾氧化浓盐酸生成氯气,氯气置换出溴,可说明氧化性高锰酸钾>Cl2>Br2,故C正确;
D.分别发生复分解反应和加成反应,不能比较稳定性,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
3.某酸性FeSO3溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2,过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如表:
(1)用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是铁粉和稀硫酸;
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为AC;
A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液
(3)通入H2S气体至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀;
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
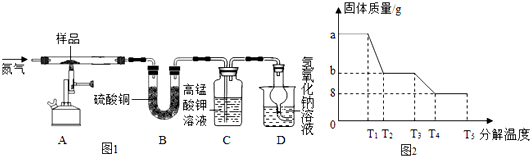
①装置B中午睡硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有二氧化硫;
②实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”);
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液;
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为7.
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为AC;
A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液
(3)通入H2S气体至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀;
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.

①装置B中午睡硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有二氧化硫;
②实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”);
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液;
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为7.
4.下列现象或事实不能用同一原理解释的是( )
| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | 硫化钠和硫酸亚铁固体长期暴露在空气中变质 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |
18.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如表:
仪器A的名称是干燥管,装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
5.下列装置或操作能达到实验目的是( )


| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
3.化学与生产、生活、社会密切相关,下列物质性质与应用对应关系正确的是( )
| A. | 明矾溶液具有酸性,可用于清除铜镜表面的铜锈 | |
| B. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| C. | 氨气能使酚酞试液变红,可用于设计喷泉实验 | |
| D. | 氧化铁能与酸反应,可用于制作红色颜料 |

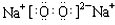 .
. .
. 、
、 .
.