题目内容
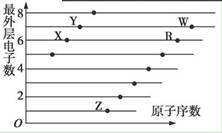
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
D
试题分析:由X2+和Z-离子的电子数之差为8和原子序数的大小关系可初步判断X为镁、Z为氯,再根据W和X元素原子内质子数之比为1:2得W质子数为6,故为碳,根据原子的最外层电子数之和为19和原子序数的关系得Y为硫,与碳相邻的同主族元素为硅,可制成重要的半导体材料,故A正确;Mg、S、Cl处于同周期,从左向右原子半径逐渐减小,故B正确;CCl4中碳原子和氯原子形成四条共价键,各原子均达到8电子的稳定结构,故C正确;根据最高价氧化物对应水化物的酸性递变规律可得酸性最强的为HClO4即HZO4,D错误;故选D。

练习册系列答案
相关题目