题目内容
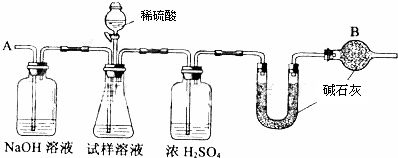
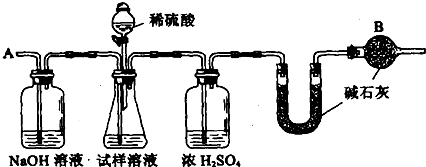
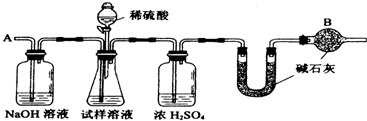
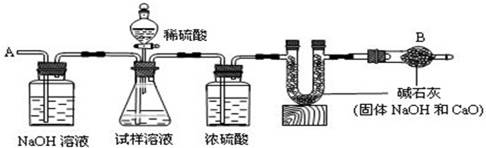
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。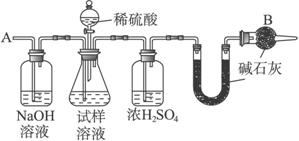
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性; ②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液; ③称量盛有碱石灰的U形管的质量,得到b g; ④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止; ⑤从导管A处缓缓鼓入一定量的空气; ⑥再次称量盛有碱石灰的U形管的质量,得到c g; ⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g。
请完成下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明_________________。
(2)装置中干燥管B的作用是______________________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果____________(填“偏高”“偏低”或“不变”)。
(4)步骤⑤的目的是_______________________________。
(5)步骤⑦的目的是_______________________________。
(6)该试样中纯碱的质量分数的计算式为_________________。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
(1)样品重,砝码轻
(2)防止空气中的CO2和水汽进入U形管中
(3)偏高
(4)把反应产生的CO2全部导入U形管中
(5)判断反应产生的CO2是否全部排出,并被U形管中的碱石灰吸收
(6)![]() ×100%
×100%
(7)答案略(见解析)。
解析:(1)托盘天平称量时,左盘放药品,右盘放砝码,若指针左偏,说明左盘较重,也就是药品质量大于砝码质量。(2)通过称量实验开始和结束时U形管的质量,可以确定产生CO2的质量,在U形管后接一个干燥管,可以防止空气中的CO2、水蒸气等进入U形管,使实验结果更为准确。(3)因盐酸是挥发性酸,生成的CO2中会混有HCl,它不能被浓H2SO4除去,但可以被碱石灰吸收,也就是实验结束后碱石灰的质量会偏大,测量的结果会偏高。(4)CO2的密度较大,生成的CO2可能会残留在锥形瓶中,鼓入空气可让生成的CO2全部导入U形管中。(5)如果两次称量U形管的结果基本不变,说明锥形瓶中所有的CO2都被碱石灰吸收了。
(6)Na2CO3+H2SO4====Na2SO4+H2O+CO2↑
106 g 44 g
m(Na2CO3) (d-b) g
所以,Na2CO3的质量分数为: ×100%=
×100%=![]() ×100%
×100%
(7)该实验的方法较多,比如可以称量一定质量的样品,加入足量的稀HNO3使CO2全部放出后滴加足量AgNO3,过滤洗净沉淀,称量后通过计算也能确定样品的纯度。其他方法只要原理正确,操作可行都是可以的。

 名校课堂系列答案
名校课堂系列答案