题目内容
【题目】根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、(明)矾而为轻粉(Hg2Cl2),加以硫磺升而为银朱(HgS)”。发生的主要化学反应方程式如下:
①HgS+O2 ===Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做_______
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式___________________________________________
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:
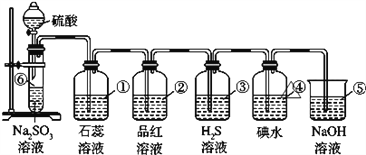
a. 实验开始前检验气体发生装置气密 性的方法为____________________(说明操作方法、现象和结论)
b. 分析下列装置中的现象分别为
①_________②__________
③_________④__________
c. ⑤的作用为_______________,所涉及的化学反应方程式为:____________________
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为______________
【答案】 c 12Hg+12NaCl+4KAl(SO4)2+3O2 ===6Hg2Cl2+6Na2SO4+2Al2O3+2K2SO4 连接好发生装置后,关闭分液漏斗活塞,并将导管浸入到水槽中液面下,然后微热试管,待导管中有气泡连续冒出,停止加热,等到冷却后导管内有水柱上升,则证明装置气密性良好 溶液变红 溶液褪色 溶液出现黄色浑浊 溶液褪色 吸收剩余SO2,防止污染空气 2NaOH + SO2 === Na2SO3 + H2O 制取出的SO2会混有HCl杂质
【解析】(1)在①的方程式中Hg元素化合价降低,S元素化合价升高,所以HgS既做氧化剂又做还原剂,答案选c;(2)反应中Hg元素化合价从0价升高到+1价,氧元素化合价从0价降低到-2价,所以根据电子得失守恒与原子守恒可知配平后的方程式为12Hg+12NaCl+4KAl(SO4)2+3O2=6Hg2Cl2+6Na2SO4+2Al2O3+2K2SO4;(3)a.装置中含有分液漏斗,则检验气体发生装置气密性的方法为:连接好发生装置后,关闭分液漏斗活塞,并将导管浸入到水槽中液面下,然后微热试管,待导管中有气泡连续冒出,停止加热,等到冷却后导管内有水柱上升,则证明装置气密性良好;b.①SO2溶于水产生亚硫酸,溶液显酸性,则实验现象是溶液变红;②SO2具有漂白性,则实验现象是溶液褪色;③SO2具有氧化性,能把H2S氧化为单质硫,则实验现象是溶液出现黄色浑浊;④碘水具有氧化性,能氧化SO2,则实验现象是溶液褪色;c.SO2是大气污染物,需要尾气处理,则⑤的作用为吸收剩余SO2,防止污染空气,反应的化学反应方程式为2NaOH+SO2=Na2SO3+H2O;d. 由于盐酸易挥发,则可能产生的影响为制取出的SO2会混有HCl杂质。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案