题目内容
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生的反应:
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol ①
C(s)+ CO2(g) 2CO(g) ΔH2="+172.5" kJ/mol ②
2CO(g) ΔH2="+172.5" kJ/mol ②
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) ΔH3="-13.7" kJ/mol ③
请回答下列问题:
(1) 计算3 Fe(s)+2 O2(g)= Fe3O4(s)的ΔH=__________________________。
(2) 800℃时,C(s)+ CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
(3) 某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol/L的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
计算:①该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式( m、n为正整数)。
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol ①
C(s)+ CO2(g)
 2CO(g) ΔH2="+172.5" kJ/mol ②
2CO(g) ΔH2="+172.5" kJ/mol ②4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) ΔH3="-13.7" kJ/mol ③
请回答下列问题:
(1) 计算3 Fe(s)+2 O2(g)= Fe3O4(s)的ΔH=__________________________。
(2) 800℃时,C(s)+ CO2(g)
 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。(3) 某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol/L的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
计算:①该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式( m、n为正整数)。
⑴-1118.3 kJ/mol ⑵正 (3)①56% ②Fe5O7或2Fe2O3·FeO
试题分析:(1)根据盖斯定律可知,(①-②)×2-③即得到3 Fe(s)+2 O2(g)=Fe3O4(s),所以该反应的ΔH=(-393.5kJ/mol-172.5 kJ/mol)×2+13.7 kJ/mol=-1118.3 kJ/mol 。
(2)当c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时
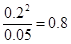 <1.64,说明反应向正反应方向进行。
<1.64,说明反应向正反应方向进行。(3)①n(Fe)=5n(KMnO4)=5×0.025 L×2 mol/L=0.25 mol
m(Fe)=0.25 mol×56 g/mol=14g
ω(Fe)=14 g÷25 g×100%=56%
②反应的铜的物质的量n(Cu)=(10 g-3.6 g)÷64 g/mol=0.1 mol
n(Fe3+)=0.2 mol
解得:n(Fe2+)=0.05 mol
该氧化物的化学式可表示为:Fe5O7或2Fe2O3·FeO
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,主要是考查学生对盖斯定律和化学计算的熟悉掌握情况,有利于培养学生的逻辑推理能力和规范答题能力,提升学生的学科素养。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
 CO2(g)+H2(g) 得到表中三组数据
CO2(g)+H2(g) 得到表中三组数据 ,
, )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应: +2H+ ═ I2+2H2O
+2H+ ═ I2+2H2O
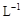 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·