题目内容
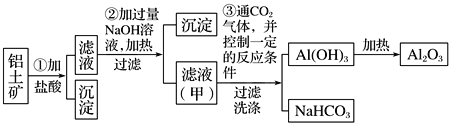
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。
回答下列问题:
(1)①中加盐酸后的沉淀主要是___________(化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________(一种即可)。
(2)写出③中可能发生反应的离子方程式。
③_____________________、________________________。
(3)步骤②中不用氨水沉淀Fe3+的原因:_______________________________________。
【答案】SiO2 粉碎铝土矿、加热、增大盐酸的浓度 OH-+CO2=HCO3- AlO2-+2H2O+CO2= Al(OH)3↓+HCO3- Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离
【解析】
铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,步骤①用盐酸溶解,发生的反应有Al2O3+6H+═2Al3++3H2O,Fe2O3+6H+═2Fe3++3H2O,过滤得到滤液为含三价铝和三价铁离子的溶液,沉淀是SiO2,溶液中加入过量的氢氧化钠生成氢氧化铁沉淀和偏铝酸钠溶液甲,甲溶液中通入过量的二氧化碳生成氢氧化铝的沉淀和碳酸氢钠溶液,再灼烧生成氧化铝,以此解题。
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,步骤①用盐酸溶解,发生的反应有Al2O3+6H+═2Al3++3H2O,Fe2O3+6H+═2Fe3++3H2O,SiO2不反应,加盐酸后的沉淀主要是SiO2,根据影响反应速率的因素,为了加快铝土矿在盐酸中的溶解,可采取的措施有粉碎铝土矿、加热、增大盐酸的浓度。
(2)滤液甲含有偏铝酸钠和氢氧化钠,向溶液中通入过量的二氧化碳,氢氧化钠和过量二氧化碳反应生成碳酸氢钠,偏铝酸钠和二氧化碳反应生成氢氧化铝的沉淀和碳酸氢钠,反应的离子方程式是OH-+CO2=HCO3-、AlO2-+2H2O+CO2= Al(OH)3↓+HCO3-。
(3) Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离,所以步骤②中不用氨水沉淀Fe3+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案