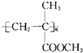
题目内容
【题目】某兴趣小组拟制备氯气并验证其一系列性质,实验装置如图所示![]() 省略夹持装置
省略夹持装置![]() 已知:硫代硫酸钠Na2S2O3溶液在工业上可作为脱氯剂
已知:硫代硫酸钠Na2S2O3溶液在工业上可作为脱氯剂
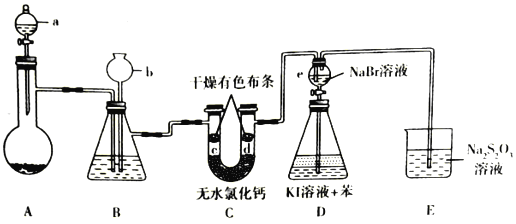
回答下列问题:
(1)仪器a的名称是______,其中盛有浓盐酸,烧瓶A中盛有的固体试剂是______![]() 填化学式
填化学式![]() .
.
(2)装置B中盛有饱和NaCl溶液,装置B的作用是______.
![]() 除去
除去![]() 中的杂质HCl
中的杂质HCl![]() 干燥
干燥 ![]() 提供后续水蒸气
提供后续水蒸气 ![]() 观察装置是否堵塞
观察装置是否堵塞
(3)![]() 处有色布条褪色,而d处不褪色,这说明______.
处有色布条褪色,而d处不褪色,这说明______.
(4)实验结束后,打开e的活塞,使其中的溶液流人到锥形瓶D中,摇匀锥形瓶,静置后可观察到______.
(5)装置E中发生反应的离子方程式为______.
【答案】 分液漏斗 KMnO4(或“KClO3”等) acd Cl2无漂白作用,HC1O起漂白作用 上层溶液为紫红色 S2O32+4Cl2+5H2O=2SO42+8Cl+10H+
【解析】由图中装置可知,装置A中放入KMnO4(或“KClO3”等)、分液漏斗中放入浓盐酸,产生的氯气通入饱和食盐水除去其中的氯化氢气体,然后通入C,干燥的有色布条,固体粒状干燥剂,可观察到c处布条褪色,d处不褪色,氯气通入漏斗D中,溶液变橙色,再滴入KI溶液与苯的分层的液体中,苯层呈紫色,最后多余的氯气用硫代硫酸钠溶液吸收,Na2S2O3中硫显+2价,被氯气氧化SO42-,以此来解答。
解析:
(1)仪器a具有玻璃活塞的漏斗,为分液漏斗,其中盛有浓盐酸,烧瓶A中在常温下氧化氯化氢制取氯气,可选择KMnO4(或“KClO3”等),反应为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,故答案为:分液漏斗;KMnO4(或“KClO3”等);
(2)氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,氯气通入C,干燥的有色布条,固体粒状干燥剂,可观察到c处布条褪色,d处不褪色,装置B提供后续水蒸气,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱,可观察装置是否堵塞,所以acd符合,故答案为:acd;
(3)向装置c中通入氯气,d处的有色布条不褪色,因为干燥的氯气不具备漂白性,c处的有色布条褪色,这说明氯气经过溶液B后带上了水,潮湿的氯气具有漂白性,真正起漂白作用的是氯气和水反应生成的次氯酸具有漂白性,故答案为:Cl2无漂白作用,HC1O起漂白作用;
(4)实验结束后,打开e的活塞,使其中的溶液流人到锥形瓶D中,溴水中加入苯振荡后苯层呈橙红发生萃取,苯的密度比水小,上层溶液为紫红色,故答案为:上层溶液为紫红色;
(5)Na2S2O3中硫显+2价,被氯气氧化SO42,则装置E中相应的离子反应方程式:S2O32+4Cl2+5H2O=2SO42+8Cl+10H+,故答案为:S2O32+4Cl2+5H2O=2SO42+8Cl+10H+

【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)X在元素周期表中的位置为____;画出X的简单离子结构示意图____。已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_______。
(2)四种元素简单离子的半径由大到小为______(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为____>____(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为___ 。