题目内容
6.设阿伏加德罗常数为NA.则下列说法正确的是( )| A. | 100 g 98%的浓硫酸中含氧原予总数为4NA | |
| B. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| C. | 常温常压下,4.6 g NO2气体含有0.3 NA个原子 | |
| D. | 常温下,2.7g、铝片投入足量的浓硫酸中,产生的SO2,分子数为0.3NA |
分析 A.浓硫酸溶液中硫酸、水都含有氧原子;
B.1个水分子含有10个电子,结合重水的相对分子质量为20解答;
C.4.6gNO2的物质的量为0.1mol,1个二氧化氮分子含有3个原子;
D.铝常温下遇到浓硫酸发生钝化.
解答 解:A.浓硫酸溶液中硫酸、水都含有氧原子,所以100g 98%的浓硫酸中含氧原子个数远远大于4NA,故A错误;
B.18g重水(D2O)的物质的量为$\frac{18g}{20g/mol}$=0.9mol,所含的电子数为9NA,故B错误;
C.1个二氧化氮分子含有3个原子,所以4.6 g(0.1mol) NO2气体含有0.3 NA个原子,故C正确;
D.铝常温下遇到浓硫酸发生钝化,常温下,2.7g、铝片投入足量的浓硫酸中,产生的SO2,分子数小于0.3NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数,掌握公式的使用和物质的结构、状态是解题关键,注意浓硫酸是强氧化性,题目难度不大.

练习册系列答案
相关题目
18.要使100mL 2mol/LNaOH溶液的物质的量浓度增大1倍,可采取的措施是( )
| A. | 加100mL水将溶液稀释 | |
| B. | 向溶液中加入0.2molNaOH固体,并使之完全溶解 | |
| C. | 将溶剂蒸发掉一半 | |
| D. | 将原溶液浓缩至50mL(无NaOH析出) |
15.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | 在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强 | |
| B. | 饱和碳酸钠溶液中:c(Na+)=2c(CO32-) | |
| C. | 饱和食盐水中:c(Na+)+c(OH-)=c(Cl-)+c(H+) | |
| D. | pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol•L-1 |
12.裂化汽油和直馏汽油之间( )
| A. | 各物理及化学性质均相同 | |
| B. | 主要成份都是烷烃,环烷烃和芳香烃 | |
| C. | 裂化汽油中含有一些不饱和链烃,而直馏汽油中不含 | |
| D. | 可以用溴水或酸性高锰酸钾溶液来区别它们 |
 已知氮化铝的晶胞结构如图所示.请回答下列问题:
已知氮化铝的晶胞结构如图所示.请回答下列问题: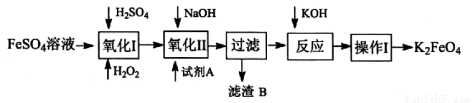
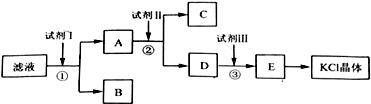
 Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
 已知:①A 是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;
已知:①A 是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平; (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C;
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C;