题目内容
14.下列方程式书写正确的是( )| A. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| B. | 往AlCl3溶液中滴加NaHCO3溶液:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 往AgI悬浊液中滴加Na2S饱和溶液:2Ag++S2-═Ag2S↓ | |
| D. | Cu(NO3)2溶液电解的离子方程式:2Cu2++2H2O═2Cu+O2↑+4H+ |
分析 A.碳酸氢根离子不能拆分;
B.相互促进水解生成沉淀和气体;
C.发生沉淀的转化;
D.电极材料未知,不能确定电极反应.
解答 解:A.NaHCO3为强电解质,其电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.往AlCl3溶液中滴加NaHCO3溶液,相互促进水解的离子反应为Al3++3HCO3-═Al(OH)3↓+3CO2↑,故B正确;
C.往AgI悬浊液中滴加Na2S饱和溶液的离子反应为2AgI+S2-═Ag2S↓+2I-,故C错误;
D.电极材料未知,不能确定电极反应,若阳极为Cu,则阳极Cu失去电子,阴极铜离子得到电子,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重电离、水解、电解及沉淀转化的离子反应考查,注意选项D为易错点,综合性较强,题目难度不大.

练习册系列答案
相关题目
5.0.5molNa2SO4( )
| A. | 含3.01×1023个SO42- | B. | 标准状况下,体积约为11.2L | ||
| C. | 含0.5molNa+ | D. | 含1mol氧原子 |
2.如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )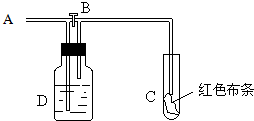

| A. | D中不可能是浓硫酸 | B. | 通入的氯气含有水蒸气 | ||
| C. | D中可以是水 | D. | D中可以是饱和食盐水 |
9.下列各组的两种物质在溶液中反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2和HCl;Cu(OH)2和CH3COOH | |
| B. | Ba(OH)2和MgSO4;BaCl2和(NH4)2SO4 | |
| C. | Na2CO3和H2SO4;K2CO3和NaHSO4 | |
| D. | NaHCO3和Ca(OH)2(过量); NaHCO3(过量)和Ca(OH)2 |
7.下列实验操作正确的是( )
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10ml量筒量取8.58ml蒸馏水 | |
| C. | 容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大 | |
| D. | 用托盘天平可以称量至0.1g |