题目内容
15.电解100mL含c(H+)=0.30mol•L-1下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Pb(NO3)2溶液 |
分析 在电解池中,阴极上阳离子的放电顺序是:银离子>铜离子>氢离子,只有放电顺序在H+前的才析出金属,根据电极反应结合电子守恒来计算即可.
解答 解:Zn2+和Pb2+的放电顺序都在H+后面,所以含有这两种阳离子的盐溶液中,阴极上放出H2,而含有银离子和铜离子这两种阳离子的盐溶液中,Ag和Cu金属先在阴极析出.
A、0.10mol∕LAgNO3溶液在氢离子之前放电,金属银的质量是 0.1mol/L×0.1L×108g/mol=1.08g,所以最多析出金属质量为1.08g;
B、Zn2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属;
C、铜离子先放电,100mL0.20mol∕LCuCl2溶液就会得到0.04mol电子,所以析出金属铜的质量为:$\frac{1}{2}$×0.04mol×64g/mol=1.28g;
D、Pb2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属.
所以析出金属质量最大的是0.20mol∕LCuCl2溶液.
故选C.
点评 本题考查学生电解池上阴极上离子的放电顺序并结合电子守恒来计算析出金属的质量,综合性较强,难度较大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 任何情况下,温度都不可能对反应的方向起决定性作用 | |
| B. | 室温下,CH3COOH的KW=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O中的c(OH-)相等 | |
| C. | 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
6.在四个不同的容器中,在不同的条件下进行合成氨反应N2+3H2?2NH3,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
3.只用一种试剂,可以一次性鉴别NH4Cl、NaCl、Na2SO4三种溶液,这种试剂是( )
| A. | Ba(OH)2溶液 | B. | KCl溶液 | C. | 酚酞溶液 | D. | 盐酸 |
10.在用Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
| A. | 锌片是正极,铜片上有气泡产生 | B. | 溶液中H2SO4 的物质的量减少 | ||
| C. | 电流方向是从锌片流向铜片 | D. | 电解液的pH保持不变 |
20.下列说法错误的是( )
| A. | 从CH4、NH4+、SO42-为正四面体结构,可推测PH4-、PO43-也为正四面体结构 | |
| B. | 1 mol金刚石晶体中,平均含有2 mol C-C键 | |
| C. | HF、HCl、HBr、HI的热稳定性从左到右依次减弱 | |
| D. | 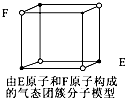 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
7.焙制糕点时,常用到小苏打粉,小苏打的化学式为( )
| A. | NaNO3 | B. | Na2CO3 | C. | NaHCO3 | D. | Na2SO4 |
4.某酯在稀硫酸中水解得到甲和乙,且甲和乙的相对分子量相等,则该酯可能为( )
| A. | 甲酸甲酯 | B. | 乙酸乙酯 | C. | 甲酸乙酯 | D. | 乙酸甲酯 |
5. 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.