题目内容
(2008?枣庄一模)现有A、B、C、D、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的单质以溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成;
③C的氢化物分子G是具有10电子微粒,且以发生下列转化:G
P
Q
M+P;
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)B元素的名称是
(2)E元素的原子结构示意图是
 .
.
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上.
(4)G的电子式为
 .化合物X所含化学键类型有
.化合物X所含化学键类型有
(5)T与F单质的水溶液反应的离子方程式为
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的单质以溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成;
③C的氢化物分子G是具有10电子微粒,且以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)B元素的名称是
钠
钠
;(2)E元素的原子结构示意图是


(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上.

(4)G的电子式为


离子键、共价键
离子键、共价键
.(5)T与F单质的水溶液反应的离子方程式为
SO2+C12+2H2O=4H++SO42-+2C1-
SO2+C12+2H2O=4H++SO42-+2C1-
;G与D的单质反应的化学方程式为4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;M与铜反应的化学方程式为
| ||
| △ |
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.分析:现有A、B、C、D、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,推断为Cl2;
②A的单质溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成,Si不能形成简单离子,则A为Al;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
P
Q
M+P,推断C为N元素,G为NH3,D为O元素,P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,则E为S,二者能形成微粒的个数比为1:2和1:3的化合物T和K,则T为SO2、K为SO3;
⑤B和O元素可形成微粒个数比为1:1和2:1的离子化合物X和Y.B为+1价离子,结合A、B、C、D离子具有相同的电子层结构,判断B为Na,则X为Na2O2,Y为Na2O.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,推断为Cl2;
②A的单质溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成,Si不能形成简单离子,则A为Al;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,则E为S,二者能形成微粒的个数比为1:2和1:3的化合物T和K,则T为SO2、K为SO3;
⑤B和O元素可形成微粒个数比为1:1和2:1的离子化合物X和Y.B为+1价离子,结合A、B、C、D离子具有相同的电子层结构,判断B为Na,则X为Na2O2,Y为Na2O.
解答:解:现有A、B、C、D、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,推断为Cl2;
②A的单质溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成,Si不能形成简单离子,则A为Al;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
P
Q
M+P,推断C为N元素,G为NH3,D为O元素,P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,则E为S,二者能形成微粒的个数比为1:2和1:3的化合物T和K,则T为SO2、K为SO3;
⑤B和O元素可形成微粒个数比为1:1和2:1的离子化合物X和Y.B为+1价离子,结合A、B、C、D离子具有相同的电子层结构,判断B为Na,则X为Na2O2,Y为Na2O,
(1)由上述分析可知,B为钠元素,
故答案为:钠;
(2)E为硫元素,原子核外有16个电子,原子结构示意图为: ,
,
故答案为: ;
;
(3)Al、N元素在元素周期表位置为: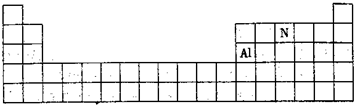 ,
,
故答案为: ;
;
(4)G为NH3,分子中N原子成3个N-H键、N原子含有1对孤对电子,电子式为: ,
,
X为Na2O2,钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(5)SO2与Cl2的水溶液反应的离子方程式为SO2+C12+2H2O=4H++SO42-+2C1-;
NH3与O2的单质反应的化学方程式为4NH3+5O2
4NO+6H2O;
酸性与铜反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:SO2+C12+2H2O=4H++SO42-+2C1-;4NH3+5O2
4NO+6H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,推断为Cl2;
②A的单质溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成,Si不能形成简单离子,则A为Al;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,则E为S,二者能形成微粒的个数比为1:2和1:3的化合物T和K,则T为SO2、K为SO3;
⑤B和O元素可形成微粒个数比为1:1和2:1的离子化合物X和Y.B为+1价离子,结合A、B、C、D离子具有相同的电子层结构,判断B为Na,则X为Na2O2,Y为Na2O,
(1)由上述分析可知,B为钠元素,
故答案为:钠;
(2)E为硫元素,原子核外有16个电子,原子结构示意图为:
 ,
,故答案为:
 ;
;(3)Al、N元素在元素周期表位置为:
 ,
,故答案为:
 ;
;(4)G为NH3,分子中N原子成3个N-H键、N原子含有1对孤对电子,电子式为:
 ,
,X为Na2O2,钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成共价键,
故答案为:
 ;离子键、共价键;
;离子键、共价键;(5)SO2与Cl2的水溶液反应的离子方程式为SO2+C12+2H2O=4H++SO42-+2C1-;
NH3与O2的单质反应的化学方程式为4NH3+5O2
| ||
| △ |
酸性与铜反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:SO2+C12+2H2O=4H++SO42-+2C1-;4NH3+5O2
| ||
| △ |
点评:本题考查了无机物推断、常用化学用语、化学键、元素化合物性质等,推断元素及物质是解题关键,注意基础知识的理解掌握,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 (2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.