题目内容
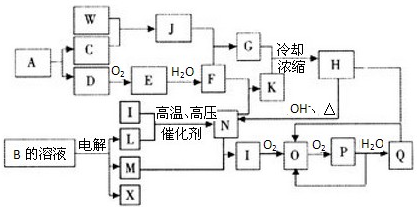
 已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
(1)若A为固体,B是黑色固体,C是臭鸡蛋气味的气体,则
①写出C的化学式:______.
②D→E为工业生产F的重要反应之一,写出此反应的化学方程式______;写出气体D使溴水褪色生成F的离子方程式______.
(2)若A为气体,C可以使湿润的红色石蕊试纸变蓝,E为红棕色气体,则
①写出A的电子式:______,C分子的空间构型为______.
②若X为铝热反应的引燃剂,写出由A生成B的化学方程式:______.
③写出D与氧气、水反应生成F的总化学方程式:______.
解:A为单质,常温下C、D为气态.F是三大强酸之一为盐酸、硫酸、硝酸,X为常见金属,
(1)若A为固体,B是黑色固体,C是臭鸡蛋气味的气体判断C为H2S;A为S,B为FeS;D为SO2,E为SO3;F为H2SO4;B为FeS;
①C的化学式为H2S,故答案为:H2S;
②D→E为工业生产F的重要反应之一,是二氧化硫催化氧化为三氧化硫的反应,此反应的化学方程式为:2SO2+O2 2SO3;气体D是二氧化硫使溴水褪色生成F的离子方程式为:
2SO3;气体D是二氧化硫使溴水褪色生成F的离子方程式为:
SO2+Br2+2H2O=SO42-+4H++2Br-,故答案为:2SO2+O2 2SO3;SO2+Br2+2H2O=SO42-+4H++2Br-;
2SO3;SO2+Br2+2H2O=SO42-+4H++2Br-;
(2)若A为气体,C可以使湿润的红色石蕊试纸变蓝,判断C为NH3,E为红棕色气体结合反应生成酸判断为NO2;D为NO;A为N2;B为;F为HNO3;
①A为N2,它的电子式为: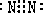 C是NH3,分子结构为三角锥形,故答案为:
C是NH3,分子结构为三角锥形,故答案为: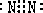 ;三角锥形;
;三角锥形;
②X为铝热反应的引燃剂判断为镁,由A生成B的化学方程式为:3Mg+N2 Mg3N2,故答案为:3Mg+N2
Mg3N2,故答案为:3Mg+N2 Mg3N2;
Mg3N2;
③D为NO与氧气、水反应生成F为HNO3的总化学方程式为:4NO+3O2+2H2O=4HNO3,故答案为:4NO+3O2+2H2O=4HNO3.
分析:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属,
(1)若A为固体,B是黑色固体,C是臭鸡蛋气味的气体判断C为H2S;A为S,B为FeS;D为SO2,E为SO3;F为H2SO4;B为FeS;
(2)若A为气体,C可以使湿润的红色石蕊试纸变蓝,判断C为NH3,E为红棕色气体结合反应生成酸判断为NO2;D为NO;A为N2;B为;F为HNO3;
依据判断出的物质分析回答问题.
点评:本题考查了物质转化关系的分析判断,物质性质的综合应用,主要考查硫及其化合物、氮及其化合物性质的综合应用,电子式的书写,化学方程式的书写,题目难度中等.
(1)若A为固体,B是黑色固体,C是臭鸡蛋气味的气体判断C为H2S;A为S,B为FeS;D为SO2,E为SO3;F为H2SO4;B为FeS;
①C的化学式为H2S,故答案为:H2S;
②D→E为工业生产F的重要反应之一,是二氧化硫催化氧化为三氧化硫的反应,此反应的化学方程式为:2SO2+O2
 2SO3;气体D是二氧化硫使溴水褪色生成F的离子方程式为:
2SO3;气体D是二氧化硫使溴水褪色生成F的离子方程式为:SO2+Br2+2H2O=SO42-+4H++2Br-,故答案为:2SO2+O2
 2SO3;SO2+Br2+2H2O=SO42-+4H++2Br-;
2SO3;SO2+Br2+2H2O=SO42-+4H++2Br-;(2)若A为气体,C可以使湿润的红色石蕊试纸变蓝,判断C为NH3,E为红棕色气体结合反应生成酸判断为NO2;D为NO;A为N2;B为;F为HNO3;
①A为N2,它的电子式为:
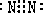 C是NH3,分子结构为三角锥形,故答案为:
C是NH3,分子结构为三角锥形,故答案为: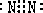 ;三角锥形;
;三角锥形;②X为铝热反应的引燃剂判断为镁,由A生成B的化学方程式为:3Mg+N2
 Mg3N2,故答案为:3Mg+N2
Mg3N2,故答案为:3Mg+N2 Mg3N2;
Mg3N2;③D为NO与氧气、水反应生成F为HNO3的总化学方程式为:4NO+3O2+2H2O=4HNO3,故答案为:4NO+3O2+2H2O=4HNO3.
分析:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属,
(1)若A为固体,B是黑色固体,C是臭鸡蛋气味的气体判断C为H2S;A为S,B为FeS;D为SO2,E为SO3;F为H2SO4;B为FeS;
(2)若A为气体,C可以使湿润的红色石蕊试纸变蓝,判断C为NH3,E为红棕色气体结合反应生成酸判断为NO2;D为NO;A为N2;B为;F为HNO3;
依据判断出的物质分析回答问题.
点评:本题考查了物质转化关系的分析判断,物质性质的综合应用,主要考查硫及其化合物、氮及其化合物性质的综合应用,电子式的书写,化学方程式的书写,题目难度中等.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
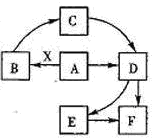 (2009?合肥二模)已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
(2009?合肥二模)已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.