题目内容
下列物质的性质按由弱到强或由低到高排列的( )A.稳定性:HF、H2O、PH3、H2S
B.酸性:H2CO3、H2SO4、HClO4、HNO3
C.与氢气反应的难易程度:F2、Cl2、Br2、I2
D.熔点:干冰、冰、氯化钠晶体、二氧化硅晶体
B、中心元素的非金属性越强,最高价氧化物对应水化物的酸性越强.
C、元素非金属性越强,单质的氧化性越强,氧化性越强反应越容易.
D、根据晶体类型及氢键判断,一般熔点原子晶体>离子晶体>分子晶体.
解答:解:A、同周期元素的原子从左到右,非金属性增强,故非金属性F>O;S>P.同主族元素的原子从上到下,非金属性减弱,故非金属性O>S.所以非金属性F>O>S>P,所以稳定性:HF>H2O>H2S>PH3,故A错误;
B、HClO4是最强的无机酸,酸性比硝酸强,故B错误;
C、同主族元素的原子从上到下,非金属性减弱,故非金属性F>Cl>Br>I,氧化性为F2>Cl2>Br2>I2,所以与氢气反应按F2、Cl2、Br2、I2顺序由易到难,故C错误;
D、干冰和冰为分子晶体,但冰中存在氢键熔点更高,氯化钠晶体为离子晶体、二氧化硅晶体为原子晶体,所以熔点二氧化硅>氯化钠>冰>干冰.故D正确.
故选:D
点评:本题考查元素周期律知识,题目难度不大,注意相关性质的比较角度以及元素周期律的主要递变规律.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
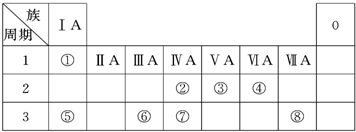
开心蛙口算题卡系列答案(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 |
|
|
| 2 |
|
|
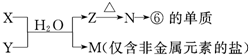
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5) W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 | | |
| 2 | | |

X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
(16分)下表为元素周期表的一部分,请用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________ ___(用元素符号表示)。
(2)请用化学方程式表示非金属性:②>⑦ _______ ____
(3)表中①、④两种元素的原子可按1:1组成一种具有二元弱酸性质的物质,请写出该物质
的电离方程式: 该弱酸性物质与⑤的最高价氧化物对应的水化物反应时可生成一种酸式盐,该酸式盐的电子式:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

A.X溶液与Y溶液反应的离子方程式为______________ _______,
B.N→⑥的单质的化学方程式为____________ ____。
C.常温下,为了使0.1 mol/L M 溶液中由M电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_____________ ____。
(5)由④、⑤、⑧三中元素形成的化合物溶液中,加入盐酸发生氧化还原反应的离子方程式是 。



 H2O+CO2↑+CO↑。用图③加热草酸晶体,验证草酸受热分解及其产物,是原中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图③不合理的地方。 答:____________; 该装置也不符合绿色化学的要求,因为______________。
H2O+CO2↑+CO↑。用图③加热草酸晶体,验证草酸受热分解及其产物,是原中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图③不合理的地方。 答:____________; 该装置也不符合绿色化学的要求,因为______________。