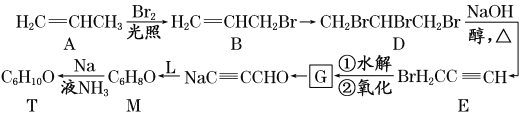
题目内容
【题目】CH4是天然气主要成分,天然气是一种高效、低耗、污染小的清洁能源,也是重要的化工原料。
(1)CH4除了可以直接燃烧供能外,还可用作燃料电池的燃料,写出如图所示甲烷燃料电池负极的电极反应式_________。

(2)以CH4为原料制取H2是工业上常用的制氢方法,化学方程式为:CH4(g)+H2O(g) CO(g)+3H2(g),该反应为吸热反应。一定温度下,将CH4和H2O(g)各0.11 mol充入2L恒容密闭容器中,50s后达平衡状态:
①若平衡时压强与初始压强比为21:11,平衡时CH4的浓度为____,50s内用H2表示该反应的平均速率 v(H2)=____。
②以下可作为该反应达平衡状态的标志的是________。
A.气体总压强保持不变 B.气体的密度保持不变 C.单位时间消耗1molCH4的同时生成3molH2 D.气体的平均摩尔质量保持不变 E.CO和H2的分子数之比为1:3
(3)与甲烷结构相似的有机物还有很多,它们的碳原子之间都以碳碳单键结合成链状,剩余价键均与氢原子结合,这样的烃称为烷烃。
①分子式为C7H16,含有三个甲基的的烷烃可能结构有_____种
②烷烃CH3CH(C2H5)C(CH3)3的一氯代物有_____种,系统命名为_______。
【答案】CH4-8e-+10OH-= CO32-+7H2O 0.005mol/L 0.0003mol/(L.s) AD 3 5 2,2,3—三甲基戊烷
【解析】
(1) 根据燃料电池原理及电解质组成分析书写电极反应式;(2) 运用三段式法根据反应速率表达式进行相关计算;根据平衡状态的本质及特征分析解答;(3) 根据甲基的数目判断支链的数目,根据碳链的异构分析解答;(4) 根据氢原子种类判断一氯取代物种类,运用系统命名法命名有机物。
(1) 碱性甲烷燃料电池中,甲烷作负极,发生氧化反应,生成CO32-,电极反应式为:CH4-8e-+10OH-= CO32-+7H2O,故答案为:CH4-8e-+10OH-= CO32-+7H2O;
(2) ① 恒容时,压强之比等于物质的量之比,则平衡时,气体总物质的量为0.11mol×2×![]() =0.42mol,设平衡时甲烷的浓度为a则
=0.42mol,设平衡时甲烷的浓度为a则

a+a+(0.11-a)+ (0.11-a)×3=0.42mol,a=0.01mol,c(CH4)=![]() ,v(H2)=3 v(CH4)=
,v(H2)=3 v(CH4)=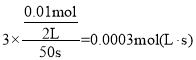 ,故答案为:0.005mol/L;0.0003mol/(L.s);
,故答案为:0.005mol/L;0.0003mol/(L.s);
②A. 该反应为气体体积增大的反应,容器为恒容,则气体总压强保持不变,说明各组分浓度保持不变,能说明反应达到平衡,故A选;
B. 反应前后气体总质量不变,气体体积恒定,则气体的密度始终保持不变,故B不选;
C. 单位时间消耗1molCH4的同时生成3molH2都表示正反应方向速率,不能说明反应达到平衡,故C不选;
D. 反应正方向为气体物质的量增大的过程,气体的总质量不变,则气体的平均摩尔质量保持不变,能说明反应达到平衡,故D选;
E. CO和H2的分子数之比为1:3,并不能说明浓度不在变化,故不能说明反应达到平衡,故E不选,故答案为:AD;
(3) ① 该烃结构式中含有3个甲基,则该烷烃只有1个支链,若支链为-CH3,主链含有6个碳原子,符合条件有:CH3CH(CH3)CH2CH2CH2CH3,CH3CH2CH(CH3)CH2CH2CH3;若支链为-CH2CH3,主链含有5个碳原子,符合条件有:CH3CH2CH(CH2CH3)CH2CH3;支链不可能大于3个碳原子,故符合条件的烷烃有3种,故答案为:3;
② CH3CH(C2H5)C(CH3)3中有5种不同化学环境的氢,则其一氯代物有5种,根据系统命名为2,2,3—三甲基戊烷,故答案为:5;2,2,3—三甲基戊烷。