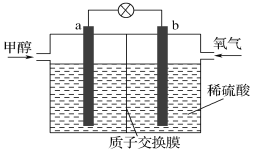
题目内容
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:
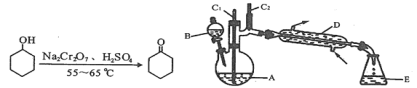
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为_______________;
②蒸馏不能分离环己酮和水的原因是______________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.往液体中加入NaCl固体至饱和,静置,分液;
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层;
c.加人无水MgSO4固体,除去有机物中少量的水;
d.过滤;
e.蒸馏、除去乙醚后,收集151~156℃馏分。
①B中水层用乙醚萃取的目的是_________;
②上述操作a、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__,操作a中,加入NaC1固体的作用是____。
③恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率为_____。(计算结果精确到0.1%)
【答案】冷凝管 打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加 环己酮和水形成具有固定组成的恒沸物一起蒸发 使水层中少量的有机物进一步被提取,提高产品的产量 漏斗、 分液漏斗 降低环己酮的溶解度,增加水层的密度,有利于分层 60.6%
【解析】
(1)装置D的名称是冷凝管;
(2)①为了防止Na2Cr2O7在氧化环己醇放出大量热,使副反应增多,应让其反应缓慢进行;
②环己酮能与水形成具有固定组成的混合物,两者能一起被蒸出;
(3)①环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,从而提高产品产量;
②分液需要的主要仪器为分液漏斗,过滤需要漏斗;
③环己醇的质量=10mL×0.96g/mL=9.6g,理论上得到环己酮质量=![]() ×98g/mol=9.408g,实际上环己酮质量=6mL×0.95g/mL=5.7g,环己酮产率=
×98g/mol=9.408g,实际上环己酮质量=6mL×0.95g/mL=5.7g,环己酮产率=![]()
(1)装置D的名称是冷凝管,具有冷凝蒸汽作用;
(2)①由于酸性Na2Cr2O7溶液氧化环己醇反应剧烈,导致体系温度迅速上升、副反应增多,所以酸性Na2Cr2O7溶液加入不能太快,应打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加;
②环己酮和水能形成具有固定组成的混合物,具有固定的沸点,蒸馏时能被一起蒸出,所以蒸馏难以分离环己酮和水的混合物。环己酮和水能够产生共沸,采取蒸馏是不可取的,建议采用精馏;
(3)①环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,能将水中的环己酮萃取到乙醚中,从而提高产品产量;
②分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器;NaCl能增加水层的密度,降低环己酮的溶解,且有利于分层;
③环己醇的质量=10mL×0.96g/mL=9.6g,理论上得到环己酮质量=![]() ×98g/mol=9.408g,实际上环己酮质量=6mL×0.95g/mL=5.7g,环己酮产率=
×98g/mol=9.408g,实际上环己酮质量=6mL×0.95g/mL=5.7g,环己酮产率=![]() =
=![]() ×100%=60.6%。
×100%=60.6%。

【题目】(物质结构与性质)元素周期表中第57号元素镧到71号元素镥这15种元素统称为镧系元素。回答下列问题:
(1)钬(Ho)可用来制作磁性材料,其基态原子电子排布式为[Xe]4f116s2,钬(Ho)有___个未成对电子。
(2)钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),该材料所含元素中,电负性最大的元素是______(填元素符号),若YBa2Cu3O7-x材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=_____。
(3)下表是几种镧系元素的电离能(单位:kJ·mol-1)
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | |
Ce | 527 | 1047 | 1949 | 3547 |
La | 538 | 1067 | 1850 | 4819 |
Lu | 532 | 1340 | 2022 | 4370 |
Yb | 604 | 1174 | 2417 | 4203 |
据此,判断形成+3价化合物最稳定的元素是____(填元素符号)。
(4)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为____,1 mol CH2=CH2中含有的σ键数目为_______;常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是_____。
(5)从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的结构如图。
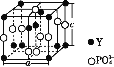
该磷钇矿的化学式为____,与PO43-互为等电子体的阴离子有____(写出两种离子的化学式)。已知晶胞参数a=0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则晶胞的密度为____g·cm-3(列出计算式)。