题目内容
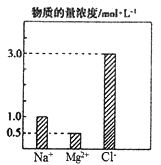
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe2+、Ba2+、H+、SO42-、CO32-。为了进一步确认,对该溶液进行实验检测:
步骤一:仔细观察,该溶液呈无色、透明、均一状态。
步骤二:加入足量BaCl2溶液,生成23.3g 白色沉淀,再加稀硝酸,沉淀不消失。
(1)原溶液中除上图中的离子以外,肯定还含有的离子是________,肯定不含有的离子是________。
(2)实验操作的步骤二中称量沉淀前的实验操作步骤有:过滤、洗涤、______________、检验沉淀已洗干净的方法是____________。
(3)原溶液中H+物质的量浓度为_________mol/L。
(4)向原溶液中加入NaHCO3溶液,反应的离子方程式为_____________。
(5)若向100 mL原溶液中加入1mo/L 的Ba(OH)2溶液,当生成的沉淀质量刚好最大时,则加入的Ba(OH)2溶液体积为_________L。
【答案】 SO42-、H+ Fe3+、Ba2+、CO32- 干燥 取最后一次洗涤液少量于试管中,加入硝酸银溶液,若无白色沉淀生成,证明已洗涤干净 3 H++HCO3-=H2O +CO2↑ 0.2
【解析】(1)溶液为无色透明,说明没有亚铁离子,加入氯化钡产生不溶于硝酸的沉淀,说明原溶液中有硫酸根离子,则没有钡离子和碳酸根离子,根据已知的离子浓度分析,现在阳离子带的电荷比阴离子带的电荷少,说明还有其他阳离子存在,则为氢离子,所以一定存在的有SO42-、H+ ,肯定不存在的有Fe3+、Ba2+、CO32-;(2)沉淀过滤洗涤干燥后才能称量,在最后一次的洗涤液中加入硝酸银,无白色沉淀则为洗涤干净,故答案为:干燥;取最后一次洗涤液少量于试管中,加入硝酸银溶液,若无白色沉淀生成,证明已洗涤干净; (3)硫酸钡沉淀的物质的量为23.3/233=0.1mol,根据溶液中的电荷守恒分析,氢离子的浓度为3.0×1+1×2-(1.0×1+0.5×2)=3mol/L,故答案为:3;(4)原溶液加入碳酸氢钠,与溶液中的氢离子反应生成二氧化碳和水,离子方程式为:H++HCO3-=H2O +CO2↑;(5)加入氢氧化钡沉淀达到最大值,则硫酸根离子和镁离子都生成沉淀,硫酸根离子为0.1mol,需要0.1mol钡离子,镁离子为0.05mol,氢离子为0.3mol,需要0.4mol氢氧根离子,所以需要0.2mol氢氧化钡溶液。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
【题目】下列分离提纯的方法不正确的是( )
选项 | 混合物 | 分离、提纯方法 |
A. | 分离苯和水 | 分液法 |
B. | 分离乙醇和甲醇 | 蒸馏法 |
C. | 除去乙炔中H2S气体 | 用CuSO4溶液洗气 |
D. | 除去水中的少量苯酚 | 过滤 |
A.A
B.B
C.C
D.D
【题目】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
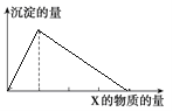
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
