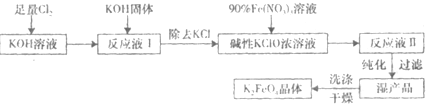
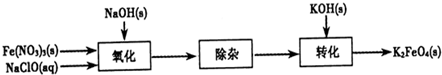
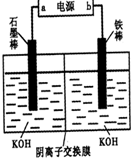
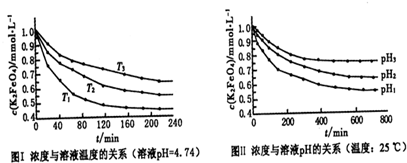
题目内容
高铁酸钾 (K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是
- A.制高铁酸钾用KClO做还原剂
- B.KCl是还原产物
- C.高铁酸钾中铁的化合价为+7
- D.制备高铁酸钾时1molFe (OH)3得到3 mol电子
B
分析:A.根据Cl元素的化合价变化来分析;
B.氧化剂对应的产物是还原产物;
C.根据化合物中化合价的代数和为0计算铁的化合价;
D.制备高铁酸钾时,铁元素失电子化合价升高.
解答:A.反应2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O中,Cl元素的化合价由+1价降低为-1价,则KClO为氧化剂,Fe(OH)3为还原剂,故A错误;
B.次氯酸钾是氧化剂,则氯化钾是还原产物,故B正确;
C.高铁酸钾中铁元素的化合价是+6价,故C错误;
D.因反应中铁元素的化合价由+3价升高到+6价,则1molFe(OH)3失去3mol电子,故D错误;
故选B.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答的关键,然后即可来分析氧化剂、还原剂,分析电子的转移数目、氧化性的比较.
分析:A.根据Cl元素的化合价变化来分析;
B.氧化剂对应的产物是还原产物;
C.根据化合物中化合价的代数和为0计算铁的化合价;
D.制备高铁酸钾时,铁元素失电子化合价升高.
解答:A.反应2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O中,Cl元素的化合价由+1价降低为-1价,则KClO为氧化剂,Fe(OH)3为还原剂,故A错误;
B.次氯酸钾是氧化剂,则氯化钾是还原产物,故B正确;
C.高铁酸钾中铁元素的化合价是+6价,故C错误;
D.因反应中铁元素的化合价由+3价升高到+6价,则1molFe(OH)3失去3mol电子,故D错误;
故选B.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答的关键,然后即可来分析氧化剂、还原剂,分析电子的转移数目、氧化性的比较.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目