题目内容
一定条件下,向容积为2L的密闭容器中充入l mol CO2和3 molH2,发生如下反应: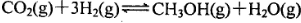 ,5 min后反应达到平衡时c(CH3OH)为0.2 mol
,5 min后反应达到平衡时c(CH3OH)为0.2 mol 。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是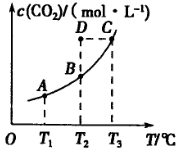
A. 0~5 min,CO2的平均反应速率为0.04 mol.(L.min)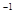 |
B.反应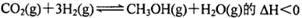 |
C.在T2℃时,若反应处于状态D,则一定有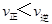 |
| D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2 |
C
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列图示与对应的叙述相符的是 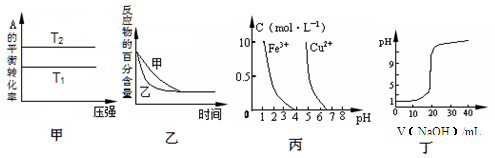
A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 ?H<0 cC(g),若T1>T2, 则a +b=c且 ?H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线 |
把下列四种x的溶液,分别加入盛有10 mL、2 mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是:
| A.20 mL,2 mol/L | B.20 mL,3 mol/L | C.10 mL,5 mol/L | D.10 mL,3 mol/L |
某温度下,对可逆反应2X(g) + Y(g) 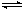 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是
| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
对于反应aA+bB=dD+eE,该化学反应速率定义为 。式中
。式中 指物质
指物质 的反应速率,
的反应速率,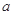 、
、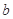 、
、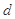 、
、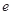 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/ mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/ mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/ mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
A.实验1、2中,
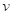 (H2O2)相等
(H2O2)相等B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时
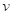 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1C.
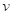 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
下列关于化学反应速率的说法正确的是 ( )
| A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 |
| B.化学反应速率为0.8 mol /(L·s)是指1s 时某物质的浓度为0.8mol/L |
| C.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D.决定反应速率的主要因素是反应物的浓度 |
 xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( ) AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应: