题目内容
在一定温度下将H2O、O2、CO2三种气体的混合气通过足量的Na2O2固体后,体积变为原来的 (同温、同压),原混合气体中H2O、O2、CO2物质的量之比可能为( )
(同温、同压),原混合气体中H2O、O2、CO2物质的量之比可能为( )A.2:7:1
B.3:14:1
C.6:7:3
D.1:7:1
【答案】分析:利用过氧化钠与水蒸气、二氧化碳气体反应前后的体积变化分析计算;
解答:解:在一定温度下将H2O、O2、CO2三种气体的混合气通过足量的Na2O2固体后发生的反应为2Na2O2+2H2O=4NaOH+O2;2Na2O2+2CO2=2Na2CO3+O2,两反应前后体积减少了原气体的一半,假设原气体体积为9,反应后体积变为原来的 (同温、同压)即最后剩余8,反应前后减少了1,原气体中氧气体积为7,二氧化碳和水蒸气体积为2,因为二氧化碳和水蒸气与过氧化钠反应体积变化相同,根据选项中的数据对比可知:
(同温、同压)即最后剩余8,反应前后减少了1,原气体中氧气体积为7,二氧化碳和水蒸气体积为2,因为二氧化碳和水蒸气与过氧化钠反应体积变化相同,根据选项中的数据对比可知:
A、选项中水蒸气体积为2,反应过程前后减少1,二氧化碳体积为1,反应前后减少0.5,不符合题意,故A不可能;
B、按照假设水蒸气体积为1.5,反应前后减少0.75,二氧化碳为0.5,反应前后减少0.25,共减少体积为1,故B可能;
C、按照假设,水蒸气体积为6,反应前后减少3,二氧化碳体积为3,反应前后减少1.5,故C不可能;
D、按照假设,水蒸气体积为1,反应前后减少0.5,二氧化碳体为1,反应前后减少0.5,共减少1,故D可能;
故选BD.
点评:本题考查了过氧化钠与水、二氧化碳反应的体积变化特点,主要是应用反应前后体积变化计算气体可能的组成.
解答:解:在一定温度下将H2O、O2、CO2三种气体的混合气通过足量的Na2O2固体后发生的反应为2Na2O2+2H2O=4NaOH+O2;2Na2O2+2CO2=2Na2CO3+O2,两反应前后体积减少了原气体的一半,假设原气体体积为9,反应后体积变为原来的
 (同温、同压)即最后剩余8,反应前后减少了1,原气体中氧气体积为7,二氧化碳和水蒸气体积为2,因为二氧化碳和水蒸气与过氧化钠反应体积变化相同,根据选项中的数据对比可知:
(同温、同压)即最后剩余8,反应前后减少了1,原气体中氧气体积为7,二氧化碳和水蒸气体积为2,因为二氧化碳和水蒸气与过氧化钠反应体积变化相同,根据选项中的数据对比可知:A、选项中水蒸气体积为2,反应过程前后减少1,二氧化碳体积为1,反应前后减少0.5,不符合题意,故A不可能;
B、按照假设水蒸气体积为1.5,反应前后减少0.75,二氧化碳为0.5,反应前后减少0.25,共减少体积为1,故B可能;
C、按照假设,水蒸气体积为6,反应前后减少3,二氧化碳体积为3,反应前后减少1.5,故C不可能;
D、按照假设,水蒸气体积为1,反应前后减少0.5,二氧化碳体为1,反应前后减少0.5,共减少1,故D可能;
故选BD.
点评:本题考查了过氧化钠与水、二氧化碳反应的体积变化特点,主要是应用反应前后体积变化计算气体可能的组成.

练习册系列答案
相关题目
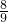 (同温、同压),原混合气体中H2O、O2、CO2物质的量之比可能为
(同温、同压),原混合气体中H2O、O2、CO2物质的量之比可能为