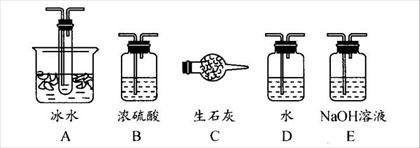
题目内容
(10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的试验。回答下列问题:
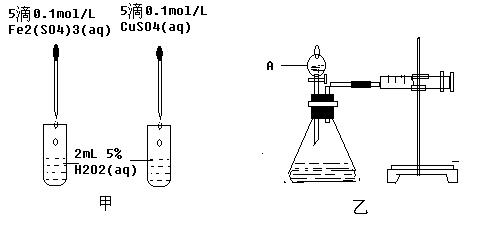
(1) 定性分析:如图甲可通过观察 ,定性比较得出结论。写出H2O2在二氧化锰作用下发生反应的化学方程式: 。
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。检查乙装置气密性的方法是 。

(1) 定性分析:如图甲可通过观察 ,定性比较得出结论。写出H2O2在二氧化锰作用下发生反应的化学方程式: 。
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。检查乙装置气密性的方法是 。

略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


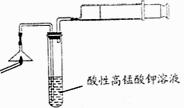
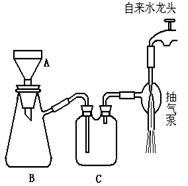
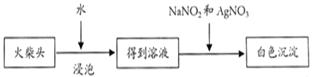

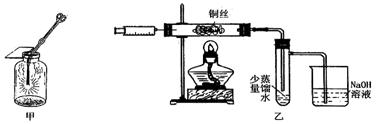
 (2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。