题目内容
【题目】(1)钙原子的结构示意图为_____。
(2)氧离子电子式为_____。
(3)0℃,1atm时,CO2的气体摩尔体积约为_____L/mol。
(4)1个普通水分子的质量大约是_____g。
(5)常温下,水的摩尔体积约为_____cm3/mol。
(6)已知n个12C原子的质量是a克,则m个32S原子的质量约是_____。
(7)电解饱和食盐水的方程式为_____;工业制漂白粉的方程式为_____。
【答案】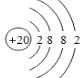
![]() 22.4 2.99×10-23 18
22.4 2.99×10-23 18 ![]() g 2NaCl+2H2O
g 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2NaOH+H2↑+Cl2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)根据原子核外电子排布书写原子结构示意图;
(2)O原子获得2个电子变为O2-;
(3)在标准状况下的气体摩尔体积是22.4L/mol;
(4)1molH2O质量是18g,其中含有H2O分子数目为6.02×1023计算;
(5)常温下,水的密度约是1g/cm3,水的摩尔质量为18g/mol,可计算出18mL水的物质的量是1mol,进而可得1molH2O的体积;
(6)先计算1个C原子的质量,然后结合相对原子质量计算1个S原子的质量,载计算m个S原子的质量;
(7)电解饱和食盐水反应产生NaOH、Cl2、H2;工业上用氯气与石灰乳反应制漂白粉。
(1)Ca原子核外电子数为20,有4个电子层,由里到外各层容纳电子数分别为2、8、8、2,原子结构示意图为: ;
;
(2)O原子最外层有6个电子,获得2个电子变为O2-,达到最外层8个电子的稳定结构,所以氧离子电子式为:![]() ;
;
(3)在标准状况下的气体摩尔体积是222.4L/mol;
(4)1mol水的质量为18g,1mol水含有约6.02×1023个水分子,则1个水分子质量为:18g÷6.02×1023≈2.99×10﹣23g;
(5)常温下,水的密度约是1g/cm3,水的摩尔质量为18g/mol,则1molH2O的体积是18mL,所以水的摩尔体积约是:18mL÷1mol=18mL/mol=18cm3/mol;
(6)1个12C原子的质量为![]() g,则1个32S原子质量为
g,则1个32S原子质量为![]() g×
g×![]() ,所以m个32S原子的质量约是为
,所以m个32S原子的质量约是为![]() g×
g×![]() ×m=
×m=![]() g;
g;
(7)电解饱和氯化钠溶液生成氢氧化钠、氯气与水,反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
2NaOH+H2↑+Cl2↑;氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.根据下表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填入对应“答案”的空格中。
实验操作 | 答案 | 实验现象 |
(1)让一束光线通过Fe(OH)3胶体 | ______ | A.呈蓝色 B.生成白色胶状沉淀 C.呈现光亮“通路” D.产生红褐色沉淀 |
(2)向盛有FeCl3溶液的试管中加入NaOH溶液 | ______ | |
(3)向Al2(SO4)3溶液中滴加氨水 | ______ | |
(4)向土豆片上滴加碘水 | ______ |
Ⅱ.某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案。
(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成。
(2)设计实验:①利用下图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是_____________。
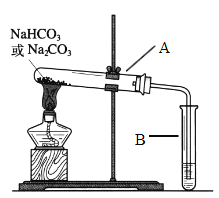
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有_______________沉淀生成(填沉淀的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3_______ NaHCO3(填“>”或“<”)。
(4)某同学在探究NaHCO3的热稳定性时,称取了8.4gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为__________L(标准状况)。