��Ŀ����
�����������ɵ����������ϳɰ����ķ��������1918��ŵ������ѧ�����ֽ������͵�������ij�ܱ������У���һ�������·�Ӧ���й�����Ϊ��
(1)�����͵�����Ӧ���ɰ���(��2 s��)�ķ�Ӧ����v(H2)��__________������ʱ�Ѵ�ƽ�⣬������ƽ�ⳣ��Ϊ__________��
(2)��ͼ��ʾ�ϳ�NH3��Ӧ��ʱ��t0��t6�з�Ӧ�����뷴Ӧ��������ͼ���������дﵽ��ѧƽ���ʱ����У���ѧƽ�ⳣ������һ��ʱ����__________��
��t0��t1����t2��t3����t3��t4����t5��t6

��t1ʱ�ı�������������¶ȣ���˵���ϳ�NH3��Ӧ���ʱ䦤H________0(����ڡ���С�ڡ�)��
| ��Ŀ | H2 | N2 | NH3 |
| ��ʼʱ | 5 mol��L��1 | 3 mol��L��1 | 0 |
| 2 sĩ | 2 mol��L��1 | | |
(1)�����͵�����Ӧ���ɰ���(��2 s��)�ķ�Ӧ����v(H2)��__________������ʱ�Ѵ�ƽ�⣬������ƽ�ⳣ��Ϊ__________��
(2)��ͼ��ʾ�ϳ�NH3��Ӧ��ʱ��t0��t6�з�Ӧ�����뷴Ӧ��������ͼ���������дﵽ��ѧƽ���ʱ����У���ѧƽ�ⳣ������һ��ʱ����__________��
��t0��t1����t2��t3����t3��t4����t5��t6

��t1ʱ�ı�������������¶ȣ���˵���ϳ�NH3��Ӧ���ʱ䦤H________0(����ڡ���С�ڡ�)��
(1)1.5 mol��L��1��s��1��0.25��(2)�١�С��
(1)���ݺϳɰ���Ӧ3H2(g)��N2(g) 2NH3(g)�ͱ������ݣ������v(H2)��1.5 mol��L��1��s��1���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊn(H2)��2 mol��L��1��n(N2)��2 mol��L��1��n(NH3)��2 mol��L��1���������ƽ�ⳣ��Ϊ0.25��
2NH3(g)�ͱ������ݣ������v(H2)��1.5 mol��L��1��s��1���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊn(H2)��2 mol��L��1��n(N2)��2 mol��L��1��n(NH3)��2 mol��L��1���������ƽ�ⳣ��Ϊ0.25��
(2)��ͼ��֪����t1��ʼ�ǻ�ѧ��Ӧ���������淴Ӧ���ʴ�������Ӧ���ʣ�˵��ƽ�������ƶ�����ѧƽ�ⳣ����С����t3��ʼ�Ƿ�Ӧ��������ƽ�ⲻ�ƶ���ƽ�ⳣ����ȣ���t4��ʼ�ǻ�ѧ��Ӧ���ʼ��٣����淴Ӧ���ʼ�С���٣���������Ӧ���ʣ�ƽ�������ƶ���ƽ�ⳣ����С���ʻ�ѧƽ�ⳣ������һ����t0��t1��
�����¶ȣ�ƽ�������ƶ����������Ƿ��ȷ�Ӧ��H<0��
 2NH3(g)�ͱ������ݣ������v(H2)��1.5 mol��L��1��s��1���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊn(H2)��2 mol��L��1��n(N2)��2 mol��L��1��n(NH3)��2 mol��L��1���������ƽ�ⳣ��Ϊ0.25��
2NH3(g)�ͱ������ݣ������v(H2)��1.5 mol��L��1��s��1���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊn(H2)��2 mol��L��1��n(N2)��2 mol��L��1��n(NH3)��2 mol��L��1���������ƽ�ⳣ��Ϊ0.25��(2)��ͼ��֪����t1��ʼ�ǻ�ѧ��Ӧ���������淴Ӧ���ʴ�������Ӧ���ʣ�˵��ƽ�������ƶ�����ѧƽ�ⳣ����С����t3��ʼ�Ƿ�Ӧ��������ƽ�ⲻ�ƶ���ƽ�ⳣ����ȣ���t4��ʼ�ǻ�ѧ��Ӧ���ʼ��٣����淴Ӧ���ʼ�С���٣���������Ӧ���ʣ�ƽ�������ƶ���ƽ�ⳣ����С���ʻ�ѧƽ�ⳣ������һ����t0��t1��
�����¶ȣ�ƽ�������ƶ����������Ƿ��ȷ�Ӧ��H<0��

��ϰ��ϵ�д�
 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
�����Ŀ
 2CO2��N2
2CO2��N2 0�����>������<������=������
0����д��>������<������=������ 2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����K300 ����K350 ������n(NO2)(��λ��mol)��ʱ��仯���±���
2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����K300 ����K350 ������n(NO2)(��λ��mol)��ʱ��仯���±��� 2CO(g) �SH��0��������������ʱ���{�¶ȣ�CO2�ķ�Ӧ���ʺ�ƽ��ת���ʾ�����
2CO(g) �SH��0��������������ʱ���{�¶ȣ�CO2�ķ�Ӧ���ʺ�ƽ��ת���ʾ�����

 ����ش��������⣺
����ش��������⣺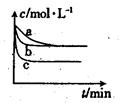
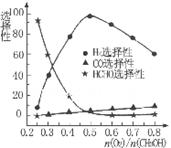
 2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
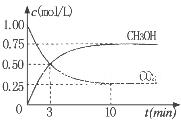
2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ� CH3OH(g)���ݻ�Ϊ1L�����ܱ������зֱ����1molCO��2molH2��ʵ���ü״������ʵ������¶ȡ�ʱ��Ĺ�ϵ������ͼ��ʾ���������Ӧ�ġ�H_______0�����������������=�������жϵ�������______��
CH3OH(g)���ݻ�Ϊ1L�����ܱ������зֱ����1molCO��2molH2��ʵ���ü״������ʵ������¶ȡ�ʱ��Ĺ�ϵ������ͼ��ʾ���������Ӧ�ġ�H_______0�����������������=�������жϵ�������______��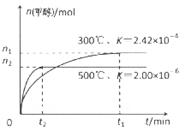
 CH3OH+H2O��
CH3OH+H2O��