题目内容
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2molL﹣1的 NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示: 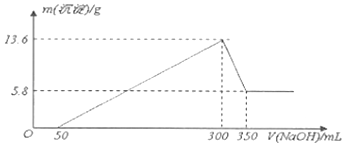
(1)0~50mL段内,发生反应的离子方程式为 .
(2)300~350mL段内,发生反应的离子方程式为 .
(3)试计算该盐酸的浓度.(写出必要的计算过程).
【答案】
(1)H++OH﹣=H2O
(2)Al(OH)3+OH﹣=AlO2﹣+2H2O
(3)![]() =3mol/L
=3mol/L
【解析】解:(1)(1)0~50mL段内,发生反应的离子方程式为H++OH﹣=H2O,所以答案是:H++OH﹣=H2O;(2)300~350mL段内,发生反应的离子方程式为Al(OH)3+OH﹣=AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;(3)沉淀量最大时,溶液为氯化钠溶液,由原子守恒可知,n(HCl)=n(NaCl)=n(NaOH)=0.3L×2mol/L=0.6mol,可知盐酸的浓度为 ![]() =3mol/L,
=3mol/L,
答:该盐酸的浓度为3mol/L.

练习册系列答案
相关题目