题目内容
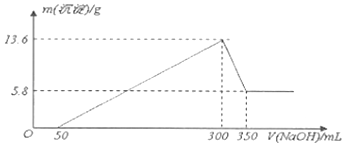
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( ) 
A.1:3
B.1:2
C.1:1
D.2:1
【答案】C
【解析】解:首先发生反应Mg2++2OH﹣═Mg(OH)2↓、Al3++3OH﹣═Al(OH)3↓,然后发生反应Al(OH)3+OH﹣═AlO2﹣+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH﹣═Al(OH)3↓可知,生成Al(OH)3沉淀消耗的氢氧化钠溶液的体积=3×10mL=30mL,图象显示,生成沉淀总共消耗氢氧化钠溶液40mL,则生成氢氧化镁沉淀需要氢氧化钠的体积为10mL,
根据Mg2++2OH﹣═Mg(OH)2↓、Al3++3OH﹣═Al(OH)3↓知,镁离子和铝离子的物质的量之比为1:2,根据原子守恒知,Al2(SO4)3与MgSO4的物质的量浓度之比= ![]() =1:1,故选C.
=1:1,故选C.
首先发生反应Mg2++2OH﹣═Mg(OH)2↓、Al3++3OH﹣═Al(OH)3↓,然后发生反应Al(OH)3+OH﹣═AlO2﹣+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH﹣═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液40mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积,从而确定溶液中n(Mg2+):n(Al3+),再根据原子守恒确定其浓度之比.

【题目】X、Y、Z、M、W为五种短周期元素.它们在周期表的相对位置如下表:则下列说法正确的是( )
M | |||||||
X | Y | Z | |||||
W |
A.Y、M形成的气态化合物在标准状况下的密度为0.76 g.L﹣1
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质一定是原子晶体
D.XZ2、X2M2、W2Z2均为直线型的共价化合物