题目内容
甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:
CH3OH(g) ![]() CH2O(g) + H2(g)
CH2O(g) + H2(g) ![]() = 84.2 kJ·mol-1 ⑴
= 84.2 kJ·mol-1 ⑴
向体系中通入空气,通过以下反应提供反应(1) 所需热量:
H2(g) + 1/2O2(g)=H2O(g) ![]() = –241.8 kJ·mol-1 (2)
= –241.8 kJ·mol-1 (2)
要使反应温度维持在700℃,计算进料中甲醇与空气的摩尔数之比。已知空气中氧气的体积分数为0.20。
要使反应维持在一定温度并持续进行,应保证反应(2)放出的热量恰好被反应(1) 全部利用,因此:
甲醇与氧气的摩尔比为:n(CH3OH): n (O2) = (2 × 241.8) / 84.2 = 5.74
甲醇与空气的摩尔比为:n(CH3OH) : n (空气) = 5.74 / 5 = 1.1
解析:
要使反应维持在一定温度持续进行,应保证反应(2)放出的热量恰好被反应(1) 全部利用。因此甲醇与氧气的物质的量之比为(2 ?? 241.8) / 84.2 = 5.74(注意保留三位有效数字),根据氧气的体积分数0.20,可求得甲醇与空气的物质的量之比。
此题需注意计算过程中有效数字的保留:乘除运算中,以有效数字最少的保留有效数字;加减运算中以小数点位数最少的保留有效数字;常数不计算有效数字等。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案(8分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备气态甲醛。甲醛与气态甲醇转化的能量关系如图所示:
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应.
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? ,理由是 。
(3)合成甲醇的主要反应为:CO(g)+2H2(g)CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
| T/℃ | T1 | T2 | T3 |
| K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为
(8分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备气态甲醛。甲醛与气态甲醇转化的能量关系如图所示: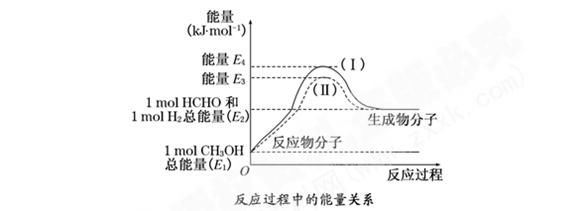
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应.
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? ,理由是  。
。
(3)合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
| T/℃ | T1 | T2 | T3 |
| K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为
(8分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备气态甲醛。甲醛与气态甲醇转化的能量关系如图所示:
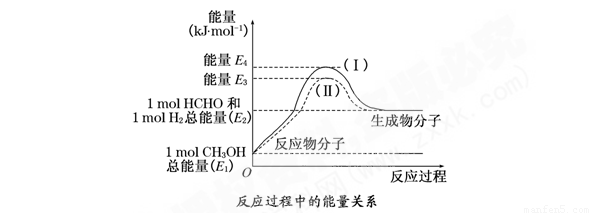
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应.
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? ,理由是 。
(3)合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
|
T/℃ |
T1 |
T2 |
T3 |
|
K |
1/1000 |
1/40 |
25 |
T1、T2、T3的大小关系为