题目内容
 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题.(1)该配位化合物的化学式为
(2)D元素原子的最外层电子排布图为
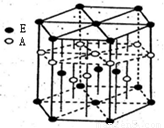
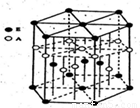
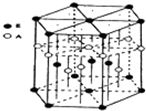
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图.则该化合物的化学式为
分析:某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+,SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4?H2O,据此解答.
解答:解:某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+,SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4?H2O,
(1)由上述分析可知,该配位化合物的化学式为:[Cu(NH3)4]SO4?H2O;
同主族自上而下第一电离能减小,故O元素第一电离能大于S元素,O与N元素同周期,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于O元素,故第一电离能由大到小的排列顺序为:N>O>S,
故答案为:[Cu(NH3)4]SO4?H2O;N>O>S;
(2)D为S元素,其原子的最外层电子排布图为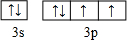 .SO42-中S原子价层电子对数=4+
.SO42-中S原子价层电子对数=4+
=4,S原子不含孤对电子,故其为正四面体构型,
故答案为: ;正四面体;
;正四面体;
(3)H元素与Cu元素可形成一种红色化合物,由晶体结构单元可知,4个H原子位于内部,6个H原子位于棱上,晶胞中H原子数目=4+6×
=6,3个Cu原子为内部,2个位于面心、12个位于顶点,故晶胞中Cu原子数目=3+2×
+12×
=6,故该化合物的化学式为CuH,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,应生成CuCl2、HCl,反应方程式为:2CuH+3Cl2
2CuCl2+2HCl,
故答案为:CuH;2CuH+3Cl2
2CuCl2+2HCl.
(1)由上述分析可知,该配位化合物的化学式为:[Cu(NH3)4]SO4?H2O;
同主族自上而下第一电离能减小,故O元素第一电离能大于S元素,O与N元素同周期,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于O元素,故第一电离能由大到小的排列顺序为:N>O>S,
故答案为:[Cu(NH3)4]SO4?H2O;N>O>S;
(2)D为S元素,其原子的最外层电子排布图为
 .SO42-中S原子价层电子对数=4+
.SO42-中S原子价层电子对数=4+| 6+2-2×4 |
| 2 |
故答案为:
 ;正四面体;
;正四面体;(3)H元素与Cu元素可形成一种红色化合物,由晶体结构单元可知,4个H原子位于内部,6个H原子位于棱上,晶胞中H原子数目=4+6×
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 6 |
| ||
故答案为:CuH;2CuH+3Cl2
| ||
点评:本题考查物质结构与性质,涉及元素化合物推断、电离能、核外电子排布、微粒构型判断、晶胞计算等,关键是根据配位化合物为深蓝色晶体进行推断,(3)中晶胞计算,为易错点,需要学生具有较好的空间想象能力与观察能力,难度中等.

练习册系列答案
相关题目