题目内容
某溶液中含有K+、NH4+、F-、I-、HSO3-,向其中加入少量Cl2后,不可能出现的变化是( )
| A、I-数目不变 | B、F-数目减少 | C、NH4+数目增大 | D、有S析出 |
分析:溶液中离子具有还原性的离子为I-、HSO3-,向其中加入少量Cl2后,会发生氧化还原反应,生成的溶液呈酸性,不可能出现的变化是微粒不变化或不能反应,或氯气通入溶液中生成酸对平衡的影响分析;
解答:解:A、如果Cl2很少,会先氧化亚硫酸氢根,所以I-数目可能不变,故A不符合;
B、F2的氧化性比Cl2强,所以Cl2不可能氧化F-,HF是弱酸,所以F-存在水解平衡,氯气通入后,溶液中H+增加,促进F-的水解,因此F-减少,故B不符合;
C、铵根离子会水解,H2O+NH4+?NH3?H2O+H+当通入Cl2时,溶液酸性增加,水解的平衡向逆方向移动,铵根离子增加,故C不符合;
D、如果有S析出,说明HSO3-作氧化剂,硫元素化合价需要降低,氯气只能把亚硫酸氢根离子氧化为硫酸根离子,不可能生成硫,故D符合;
故选:D.
B、F2的氧化性比Cl2强,所以Cl2不可能氧化F-,HF是弱酸,所以F-存在水解平衡,氯气通入后,溶液中H+增加,促进F-的水解,因此F-减少,故B不符合;
C、铵根离子会水解,H2O+NH4+?NH3?H2O+H+当通入Cl2时,溶液酸性增加,水解的平衡向逆方向移动,铵根离子增加,故C不符合;
D、如果有S析出,说明HSO3-作氧化剂,硫元素化合价需要降低,氯气只能把亚硫酸氢根离子氧化为硫酸根离子,不可能生成硫,故D符合;
故选:D.
点评:本题考查了离子性质的分析应用,氯气的氧化性和溶于水形成溶液的酸性是影响离子变化的关键,题目难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
已知:HCO3—+AlO2—+H2O=Al(OH)3↓+CO32—某溶液中可能含有OH?,CO32?,AlO2?,SiO32?,SO42?,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中不正确的是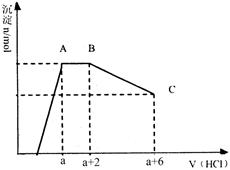
| A.原溶液肯定含有OH?,CO32?,AlO2?,SiO32? | B.K+和Na+至少含有其中一种 |
| C.n(CO32?):n(AlO2?)=3:2 | D.a值肯定大于4/3 |
 (1)某混合溶液中,可能含有的离子如下表:
(1)某混合溶液中,可能含有的离子如下表: