��Ŀ����
(14��)��֪X��Y��Z��W�Ƕ�����Ԫ���е����ַǽ���Ԫ�أ����ǵ�ԭ��������������X��Y��Z�ĵ����ڳ����¾�Ϊ��ɫ���壬Yԭ�ӵ��������������ڲ��������2����
��1��Z���ӵĵ���ʽΪ�� ��Y�ĵ����ж��֣����п��Ե����һ���ǣ� ��
��2����һ�������£���x������z���ʷ�Ӧ����1molE�ų�������Ϊ46��2kJ��д���÷�Ӧ���� ��ѧ����ʽ�� ��E�ڴ������ڵ������£������ڻ�ԭ����β���е� ���Լ��ٶԴ�������Ⱦ��
��3������X��Z��W����Ԫ����ɵ�ij������һ����Ч���ʣ�������ʩ�û�ʹ�����ữ���йص����ӷ���ʽΪ ��
��4����ҵ�Ͽ���E��Ũ��Һ���������������Ĺܵ��Ƿ�©������©��ʱ�ɹ۲쵽�������̣�ͬʱ�е���z���ɣ�д����Ӧ�Ļ�ѧ����ʽ�� ���÷�Ӧ�б�������E����뷴Ӧ��E������֮��Ϊ ��
��1��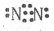 ʯī
ʯī
��2��N2(g)+3H2(g)  2NH3(g);
2NH3(g);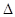 H=-92.4kj/mol;
NO��NO2
H=-92.4kj/mol;
NO��NO2
��3��NH4+ +H2O NH3+H2O+H-
NH3+H2O+H-
��4��8NH3 +3l 2=6NH4Cl+N2 1:4
��������

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
