题目内容
6.在反应3Cl2+8NH3→6NH4Cl+N2中,下列说法正确的是(设阿伏加德罗常数为NA)( )| A. | 若有3molCl2参加反应,得到氧化产物6 mol | |
| B. | 若常温下生成22.4L氮气,转移的电子数为6NA | |
| C. | 若转移6 mol电子,则被氧化的氨气是8 mol | |
| D. | 若生成1mol的氯化铵转移电子数是n个,则NA=n |
分析 在反应3Cl2+8NH3→6NH4Cl+N2中,Cl的化合价降低,N的化合价升高,3molCl2参加反应,2molNH3被氧化,得到氧化产物1 mol,转移电子为6mol;
A.氧化产物是N2;
B.常温下气体摩尔体积的数值不知道;
C.2molNH3被氧化,转移电子为6mol;
D.根据方程式中电子与氯化铵的关系计算.
解答 解:在反应3Cl2+8NH3→6NH4Cl+N2中,Cl的化合价降低,N的化合价升高,3molCl2参加反应,2molNH3被氧化,得到氧化产物1 mol,转移电子为6mol;
A.氧化产物是N2,3molCl2参加反应,2molNH3被氧化,得到氧化产物1 mol,故A错误;
B.常温下气体摩尔体积的数值不知道,无法计算22.4L氮气的物质的量,所以转移电子数无法计算,故B错误;
C.若转移6 mol电子,参加反应的氨气是8mol,而被氧化的氨气是2mol,故C错误;
D.由方程式可知,生成6mol氯化铵,转移6mol电子,则生成1mol的氯化铵转移1mol电子,若电子数是n个,则NA=n,故D正确;
故选D.
点评 本题考查了氧化还原反应、物质的量的计算,题目难度不大,注意从化合价的角度分析氧化还原反应,注意把握物质的量的有关计算公式.

练习册系列答案
相关题目
12.有如下合成路线,甲经二步转化为丙:

下列叙述错误的是( )

下列叙述错误的是( )
| A. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 | |
| B. | 反应(1)的无机试剂是液溴,铁作催化剂 | |
| C. | 甲和丙均可与酸性KMnO4溶液发生反应 | |
| D. | 乙属于烃的衍生物,其所含官能团可能为溴原子 |
13.萜品醇可作为消毒剂、抗氧化剂和溶剂,已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
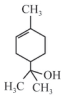

| A. | 1mol该物质最多能和1mol氢气发生加成反应 | |
| B. | 该物质不属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
1.下列说法不正确的是( )
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | 淀粉、纤维素都用(C6H10O5)n表示,二者互为同分异构体 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
11.两种互为同位素的原子,不同的是( )
| A. | 核电荷数 | B. | 电子层结构 | C. | 核外电子数 | D. | 质量数 |
15.下列有机分子中,存在顺反异构现象的是( )
| A. | 2-甲基-1-丙烯 | B. | 1-丁烯 | ||
| C. | 2-丁烯 | D. | 2,3-二甲基-2-丁烯 |
16.PX是纺织工业的基础原料,其结构简式如下,下列说法正确的是( )


| A. | PX的分子式为C8H10 | B. | PX的一氯代物有3种 | ||
| C. | PX与乙苯互为同系物 | D. | PX分子中所有原子都处于同一平面 |
 甲醇是一种优质燃料,可制作燃料电池.
甲醇是一种优质燃料,可制作燃料电池. 硫酸工业尾气中二氧化硫易造成环境污染,必须处理.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其循环再生机理如图所示,
硫酸工业尾气中二氧化硫易造成环境污染,必须处理.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其循环再生机理如图所示,