题目内容
【题目】氢气是重要的清洁能源。科学家尝试多种方法制取氢气。
I.(1)储氢材料![]() 能与水反应得到氢气。请写出
能与水反应得到氢气。请写出![]() 的电子式______________,该反应的化学方程式为______________________________。
的电子式______________,该反应的化学方程式为______________________________。
Ⅱ.甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整( |
|
甘油部分氧化( |
|
甘油氧化水蒸汽重整( |
|
(2)反应![]() 的H1=_____ kJmol-1。
的H1=_____ kJmol-1。
(3)实际生产中将反应![]() 设定在600~700℃进行,选择该温度范围的原因是:________________。
设定在600~700℃进行,选择该温度范围的原因是:________________。
(4)反应![]() 的副产物很多,加入一定量的
的副产物很多,加入一定量的![]() 通入适当过量的
通入适当过量的![]() 都能提高氢气的产率。则加入
都能提高氢气的产率。则加入![]() 的原因:___________________;若混合气体中,
的原因:___________________;若混合气体中,![]() 比例过高,则
比例过高,则![]() 产率降低,其原因是:____________________________。
产率降低,其原因是:____________________________。
(5)通常将![]() 分散在高比表面的载体(
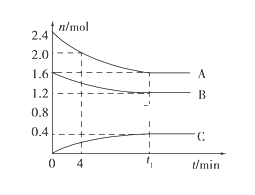
分散在高比表面的载体(![]() )上以提高催化效率。分别用三种催化剂的载体进行实验,持续通入原料气一段时间,绘制油转化率与时间的关系如图所示。
)上以提高催化效率。分别用三种催化剂的载体进行实验,持续通入原料气一段时间,绘制油转化率与时间的关系如图所示。

①结合上图分析![]() 催化剂具有的优点是____________________。
催化剂具有的优点是____________________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(![]() )可有效减少积碳。其反应机理包括两步:
)可有效减少积碳。其反应机理包括两步:
第一步为:![]()
第二步为:___________________________(写出化学反应方程式)。
【答案】Na+[:H]- NaH+H2O=NaOH+H2↑ +128 催化剂活性和选择性高、升高温度反应速率加快 CaO结合CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高 甘油直接燃烧不产生H2,或过量O2会与H2反应 催化效率高,稳定性高(或催化剂寿命长) La2O2CO3+C=La2O3+2CO↑
【解析】
I.(1)NaH由Na+和H-构成,电子式为Na+[:H]-,NaH与水反应,生成NaOH和H2,该反应的化学方程式为NaH+H2O=NaOH+H2↑。答案为:Na+[:H]-;NaH+H2O=NaOH+H2↑;
Ⅱ.(2)![]() H2=-1206kJmol-1 ①
H2=-1206kJmol-1 ①
![]() H3=-950kJmol-1 ②
H3=-950kJmol-1 ②
利用盖斯定律,将(②-①)×![]() ,得
,得![]() H1=+128kJmol-1。答案为:+128;
H1=+128kJmol-1。答案为:+128;
(3)实际生产中将反应![]() 设定在600~700℃进行,选择该温度范围,主要从催化剂的活性和温度对反应速率的影响考虑,其原因是:催化剂活性和选择性高、升高温度反应速率加快;
设定在600~700℃进行,选择该温度范围,主要从催化剂的活性和温度对反应速率的影响考虑,其原因是:催化剂活性和选择性高、升高温度反应速率加快;
(4)加入CaO,可吸收产物中的CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高;若混合气体中,![]() 比例过高,则
比例过高,则![]() 产率降低,其原因是:甘油直接燃烧不产生H2,或过量O2会与H2反应。答案为:CaO结合CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高;甘油直接燃烧不产生H2,或过量O2会与H2反应;
产率降低,其原因是:甘油直接燃烧不产生H2,或过量O2会与H2反应。答案为:CaO结合CO2生成CaCO3,使反应Ⅰ平衡正向移动,H2产率提高;甘油直接燃烧不产生H2,或过量O2会与H2反应;
(5)①从图中可以看出,随着时间的延长,其催化效率基本不变,所以![]() 催化剂具有的优点是催化效率高,稳定性高(或催化剂寿命长)。答案为:催化效率高,稳定性高(或催化剂寿命长);
催化剂具有的优点是催化效率高,稳定性高(或催化剂寿命长)。答案为:催化效率高,稳定性高(或催化剂寿命长);
②题中强调氧化镧可循环利用,则应分解生成La2O3,反应方程式为La2O2CO3+C=La2O3+2CO↑。答案为:La2O2CO3+C=La2O3+2CO↑。