题目内容
【题目】实验室制取的乙烯中常混有少量的SO2,有人设计如下图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
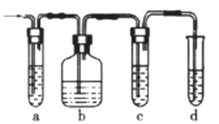
(1)能说明SO2存在的实验现象是__________________。
(2)使用装置b的目的是_________________________。
(3)使用装置c的目的是_________________________。
(4)能证明混合气体中含有乙烯的现象是___________。
(5)图中a、b、c、d装置盛放的试剂依次是____________(填序号)。
A.品红溶液 B. NaOH溶液 C.浓硫酸 D.酸性高锰酸钾溶液
书写B中发生的化学反应方程式_________。
【答案】 装置a中品红溶液褪色 除去SO2气体,以免干扰乙烯的检验实验 检验SO2气体是否除尽 装置c中品红溶液不褪色,装置d中酸性高锰酸钾溶液褪色 A、B、A、D 2NaOH+SO2=Na2SO3+H2O
【解析】乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(2NaOH+SO2=Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验,则a中为品红.乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,所以b中为氢氧化钠溶液,再通过品红溶液不褪色确认SO2已除干净,则c为品红溶液.最后用溴水或酸性高锰酸钾溶液褪色实验检验乙烯,则d为溴水或酸性高锰酸钾溶液。则
(1)二氧化硫是否存在可用品红溶液检验,能说明SO2存在的实验现象是装置a中品红溶液褪色;(2)乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,二氧化硫的存在影响乙烯的检验,故检验乙烯时应先除去二氧化硫,则装置b的目的为除去二氧化硫气体,以免干扰乙烯的实验;(3)通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,则装置c的目的为检验二氧化硫是否除尽;(4)最后用高锰酸钾酸性溶液褪色实验检验乙烯,装置d中的酸性高锰酸钾溶液褪色,说明含有乙烯,即能确认C2H4气体存在的现象是装置c中的品红溶液不褪色,装置d中的酸性高锰酸钾溶液褪色;(5)根据以上分析可知图中a、b、c、d装置盛放的试剂依次是品红溶液、NaOH溶液、品红溶液、酸性高锰酸钾溶液,其中B中发生的化学反应方程式为2NaOH+SO2=Na2SO3+H2O。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氧化铝熔点很高 | 制造耐火坩埚 |
C. | 硅有导电性 | 制造光导纤维 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A.A
B.B
C.C
D.D