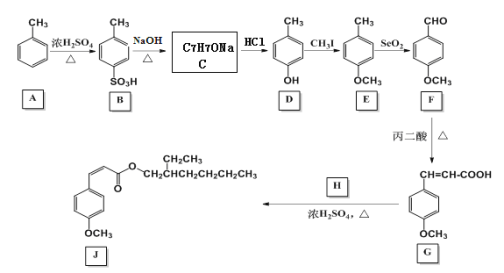
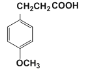
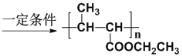题目内容
【题目】按要求完成下列各题:
(1)KOH的电子式:____________, CH(CH3)3的名称为:______________。
(2)有五种物质 :①Cu、②H2CO3、③BaSO4、④盐酸、⑤SO2,其中弱电解质是______(填序号,下同) ,非电解质是________________。
(3)钠与水反应的化学方程式为:_____________________。
已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:_________________________________。
【答案】![]() 异丁烷 ② ⑤ 2Na+2H2O=2NaOH+H2↑ 2Fe2++ClO-+2H+===2Fe3++Cl-+H2O
异丁烷 ② ⑤ 2Na+2H2O=2NaOH+H2↑ 2Fe2++ClO-+2H+===2Fe3++Cl-+H2O
【解析】
(1)KOH的电子式: ![]() , CH(CH3)3的名称为: 异丁烷。
, CH(CH3)3的名称为: 异丁烷。
(2)①Cu、②H2CO3、③BaSO4、④盐酸、⑤SO2,这五种物质中,铜是单质,盐酸是混合物,单质和混合物既不是电解质也不是非电解质;硫酸钡是盐,酸碱盐都是电解质,弱酸和弱碱都是弱电解质,其中碳酸是弱酸,所以弱电解质是②;非金属氧化物除水外都是非电解质,所以非电解质是⑤SO2。
(3)钠与水反应生成氢氧化钠和氢气,化学方程式为:2Na+2H2O=2NaOH+H2↑。
已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,说明溶液中的亚铁离子被氧化为铁离子,次氯酸根被还原为氯离子,该反应的离子方程式为2Fe2++ClO-+2H+===2Fe3++Cl-+H2O。

【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 比较Cl2与H2SO4氧化性强弱 | 向漂白粉中加入4mol·L-1硫酸,观察有无黄绿色气体 |
B | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3稀溶液,出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
D | 向苯酚钠溶液中通入CO2,溶液变浑浊 | 结合H+能力: C6H5O->CO32- >HCO3- |
A.AB.BC.CD.D