题目内容
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________。关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
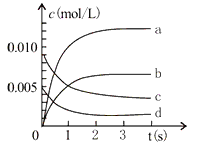
(2)下图中表示NO2的变化的曲线是____________________。用O2表示从0-2s内该反应的平均速率v=_______________。
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正 (O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
【答案】 ![]() C b
C b ![]() BC C
BC C
【解析】(1)在2L密闭容器内,800℃时反应为:2NO(g)+O2(g) ![]() 2NO2(g),此反应的平衡常数表达式为K=c2(NO2)/ c2(NO) ·c(O2);已知:K300℃>K350℃,升高温度,平衡常数减小,则平衡逆向移动,说明正反应是放热反应(△H<0),由方程式前后气体分子数减小,说明正反应是熵减过程(△S<0),所以选C。
2NO2(g),此反应的平衡常数表达式为K=c2(NO2)/ c2(NO) ·c(O2);已知:K300℃>K350℃,升高温度,平衡常数减小,则平衡逆向移动,说明正反应是放热反应(△H<0),由方程式前后气体分子数减小,说明正反应是熵减过程(△S<0),所以选C。
(2)NO2的计量数与NO的计量数相等,则它们的浓度变化量相等,由图中数据分析可知图中表示NO2的变化的曲线是b;从0-2s,O2的浓度由0.005mol/L变化到0.002mol/L,ν(O2)== Δc(O2)/ Δt==0.003mol/L÷2s== 0.0015mol·L—1·s—1;
(3)A.v(NO2)=2v(O2),速率没有正、逆,无法比较,A错误;在2L密闭容器内,发生2NO(g)+O2(g) ![]() 2NO2(g),气体分子数前后不同,压强不同,当压强一定时能说明该反应已达到平衡状态,B正确;C.v逆 (NO)=2v正 (O2),NO的正、逆反应速率相等,达到平衡状态,C正确;整个反应体系都气体,则气体总质量不变,容积不变,密度就不变,所以密度不能作为反应平衡标志,D错误。
2NO2(g),气体分子数前后不同,压强不同,当压强一定时能说明该反应已达到平衡状态,B正确;C.v逆 (NO)=2v正 (O2),NO的正、逆反应速率相等,达到平衡状态,C正确;整个反应体系都气体,则气体总质量不变,容积不变,密度就不变,所以密度不能作为反应平衡标志,D错误。
(4)2NO(g)+O2(g) ![]() 2NO2(g),△H<0,升高温度,平衡逆向移动,n(NO2)/n(NO)减小;加入催化剂,平衡不移动,n(NO2)/n(NO)不变;恒容容器中不断充入O2,平衡正向移动,n(NO2)/n(NO)变大;恒容容器中充入He(g),参与反应物质浓度不变,平衡不移动,n(NO2)/n(NO)不变。
2NO2(g),△H<0,升高温度,平衡逆向移动,n(NO2)/n(NO)减小;加入催化剂,平衡不移动,n(NO2)/n(NO)不变;恒容容器中不断充入O2,平衡正向移动,n(NO2)/n(NO)变大;恒容容器中充入He(g),参与反应物质浓度不变,平衡不移动,n(NO2)/n(NO)不变。

【题目】测定CuSO4·xH2O晶体的x值,数据如表中所示,己知x的理论值为5.0,产生误差的可能原因是
坩埚质量 | 坩埚+试样 | 失水后,坩埚+试样 |
11.70g | 20.82g | 16.50g |
A. 晶体中含不挥发杂质 B. 未做恒重操作
C. 加热时有晶体溅出 D. 加热前晶体未研磨