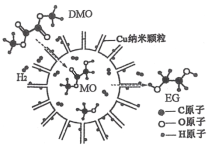
题目内容
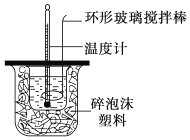
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量____________________。
(2)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为___________。
【答案】确保盐酸被完全中和 C D △H1=△H2<△H3
【解析】
(1)为了确保盐酸反应完全,所用NaOH稍过量;
(2)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(3)盐酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使盐酸与NaOH溶液混合均匀;
(4)弱电解质存在电离平衡,弱电解质的电离过程是吸热过程。
(1)实验中,所用NaOH稍过量的原因是确保盐酸反应完全;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故合理选项是C;
(3)使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动,促进酸、碱快速混合,迅速发生中和反应,故合理选项是D;
(4)稀溶液中,强酸与强碱发生中和反应生成1mol水放出57.3kJ的热量;氢氧化钠、氢氧化钙属于强碱,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L1mol/L的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,其电离过程是吸热过程,所以稀氨水和1L1mol/L的稀盐酸恰好完全反应放热小于57.3kJ,反应放出的热量越小,则反应热越大,所以△H1=△H2<△H3。

【题目】下列“实验结论”与“实验操作及现象”不相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向KI―淀粉溶液中滴加氯水,溶液变成蓝色 | 氧化性:Cl2>I2 |
B | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有吸水性 |
C | 向某盐溶液中滴加KSCN溶液,溶液变为红色 | 该溶液中含有Fe3+ |
D | 向某盐溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中含有 |
A.AB.BC.CD.D
【题目】下列实验操作不能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 比较金属镁和铝的活泼性 | 分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象 |
B | 除去Mg粉中混有的Al 粉 | 加入足量的NaOH 溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水 |
A. AB. BC. CD. D
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化