题目内容
【题目】雾霾含有大量的污染物SO2、NO.工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):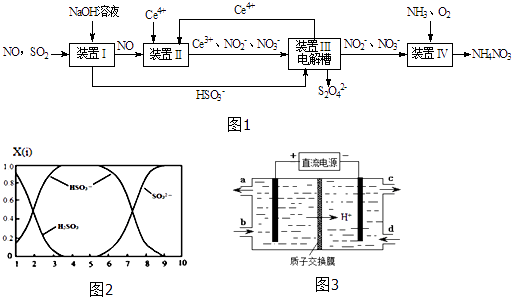
(1)装置Ⅰ中的主要离子方程式为 .
(2)含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图2所示.①若是0.1mol NaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 .
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: .
(3)写出装置Ⅱ中,酸性条件下的离子方程式 .
(4)装置Ⅲ还可以使Ce4+再生,其原理如图3所示.①生成Ce4+从电解槽的(填字母序号)口流出.
②写出与阴极的反应式 .
(5)已知进入装置Ⅳ的溶液中,NO2﹣的浓度为a gL﹣1 , 要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 需至少向装置Ⅳ中通入标准状况下的O2L.(用含a代数式表示,计算结果保留整数)
【答案】
(1)SO2+OH﹣=HSO3﹣
(2)c(Na+)>c(SO32﹣)>c(HSO3﹣)>c(OH﹣)>c(H+);HSO3﹣在溶液中存在电离平衡:HSO3﹣?SO32﹣+H+ , 加CaCl2溶液后,Ca2++SO32﹣=CaSO3↓使电离平衡右移,c(H+)增大
(3)NO+2H2O+3Ce4+=3Ce3++NO3﹣+4H+
(4)a;2HSO3﹣+4H++4e﹣=S2O32﹣+3H2O
(5)243a
【解析】解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH﹣=HSO3﹣ , NO和氢氧化钠之间不会反应,故答案为:SO2+OH﹣=HSO3﹣;(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(Na+)>c(SO32﹣)>c(HSO3﹣)>c(OH﹣)>c(H+),故答案为:c(Na+)>c(SO32﹣)>c(HSO3﹣)>c(OH﹣)>c(H+);②NaHSO3溶液中HSO3﹣的电离大于水解,HSO3﹣SO32﹣+H+ , 溶液显示酸性,加入CaCl2溶液后,Ca2++SO32﹣=CaSO3↓使电离平衡右移,故答案为:HSO3﹣在溶液中存在电离平衡:HSO3﹣SO32﹣+H+ , 加CaCl2溶液后,Ca2++SO32﹣=CaSO3↓使电离平衡右移,c(H+)增大;(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2﹣+2H+ , 故答案为:NO+2H2O+3Ce4+=3Ce3++NO3﹣+4H+;(4)①在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出,故答案为:a;②电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3﹣+4H++4e﹣=S2O32﹣+3H2O,故答案为:2HSO3﹣+4H++4e﹣=S2O32﹣+3H2O;(5)NO2﹣的浓度为a gL﹣1 , 要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 则失去电子数目是: ![]() ,设消耗标况下氧气的体积是V,则失电子数目是:
,设消耗标况下氧气的体积是V,则失电子数目是: ![]() ,根据电子守恒:
,根据电子守恒: ![]() =
= ![]() ,解得V=243a,故答案为:243a. (1)二氧化硫是酸性氧化物,能和强碱之间发生反应;(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,根据离子浓度大小比较的方法来回答;②NaHSO3溶液中HSO3﹣的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;(4)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;(5)根据氧化还原反应中电子守恒来计算.
,解得V=243a,故答案为:243a. (1)二氧化硫是酸性氧化物,能和强碱之间发生反应;(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,根据离子浓度大小比较的方法来回答;②NaHSO3溶液中HSO3﹣的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;(4)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;(5)根据氧化还原反应中电子守恒来计算.

 名校课堂系列答案
名校课堂系列答案