题目内容
17.已知c(NH4Cl)<0.1moL/L时,溶液的pH>5.1,现用0.1mol/L盐酸滴定10mL0.05mol/L氨水,用甲基橙作指示剂,达到终点时所用盐酸的量应是( )| A. | 10 mL | B. | 5 mL | C. | 大于5mL | D. | 小于5mL |
分析 按照酸碱恰好中和反应进行计算,可知需消耗盐酸体积为5ml,依据题干信息可知,此时溶液PH值大于5.1,而甲基橙的变色范围在3.1-4.4范围,不变色,故应继续向其中滴加盐酸方可发生变色.
解答 解:按照酸碱恰好中和反应:HCl+NH3•H20=NH4Cl+H20进行计算,可知滴定10mL0.05mol/L氨水需消耗0.1mol/L盐酸体积为5ml,依据题干信息可知,此时溶液PH值大于5.1,而甲基橙的变色范围在3.1-4.4范围,不变色,故应继续向其中滴加盐酸方可发生变色,所以终点时所用盐酸的量应大于5mL,
故选C.
点评 本题主要考查了酸碱中和反应,指示剂的选择对测定结果的影响,题目难度不大,注意变色范围.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
7.在化学学习与研究中经常采用“推理”的思维方式.下列“推理”正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,则甲苯也不能使酸性高锰酸钾溶液褪色 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,则SiH4沸点高于CH4 | |
| C. | 加热蒸发食盐水可以得到NaCl(s),则加热蒸发FeCl3溶液可以获得FeCl3(s) | |
| D. | 盐酸和氧化亚铁反应只生成盐和水,则硝酸和氧化亚铁反应也只生成盐和水 |
8.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确是( )
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-10mol/L | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
5.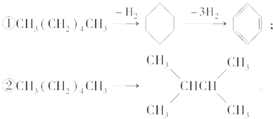 增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )
 增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )| A. | 石油分馏后得到的汽油远不能满足需求,故常用裂化等方法生产更多的轻质油 | |
| B. | 使用含铅抗爆剂,会导致铅污染,故目前已禁止使用 | |
| C. | ①②均为消去反应 | |
| D. | ①②反应过程中有机物碳原子数均没有发生变化 |
2.有人设计了以下反应途径制H2,假设反应都能进行,你认为最合理的是( )
| A. | C3H8$\stackrel{极高温}{→}$3C+4H2 | |
| B. | C3H8$\stackrel{高温脱氢}{→}$C3H6+H2 | |
| C. | C3H8+3H2O$\stackrel{催化剂}{→}$3CO+7H2 | |
| D. | C3H8+5O2→3CO2+4H2O,2H2O$\stackrel{电解}{→}$2H2↑+O2↑ |
7.下列叙述错误的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 物质的量是度量物质所含微观粒子多少的物理量 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 等质量的O2和O3中所含氧原子个数相同 |
 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知: E; ③
E; ③ H;
H; I;⑤
I;⑤ G; ⑥
G; ⑥ J.
J.