题目内容
【题目】某有色金属研究室对从银锰精矿中提取单质银的方法进行改良创新,从而更高效地实现锰和银的分离。其简易流程如下图。已知:银锰精矿主要成分为MnO2和银单质。
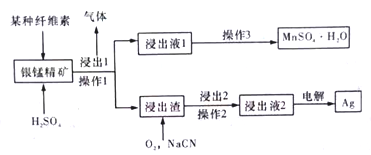

(1)操作1与操作2所对应的分离方法是__________________。
(2)通过对“浸出1”步骤中纤维细度的控制,绘制出一定时间内纤维素-Mn浸出率图象如上图所示,实际生产中应控制细度________mm较为合适,理由是_________。
(3)在“浸出1”步骤中,纤维素会先水解为单糖,请写出该单糖(用分子式表达)与银锰精矿反应的离子方程式:_______________________。
(4)浸出液2的主要成分为[Ag(CN)2]-,使用情性电极电解浸出液2,请写出阴极的电极方程式:________。本流程中可循环使用的物质为_________________。
(5)通过上述流程,浸出液1中通常还含有少量银离子,充分提取银,可对MnSO4·H2O晶体进行洗涤,请简述洗涤的方法_____________________________。将洗涤液与母液合并,加入盐酸,过滤后再经过以下步骤可回收大部分浸出液1中的银。试剂a是______________。
![]()
【答案】 过滤 0.5 细度为0.35 mm时,对生产工艺要求更高,但浸出率提升不明显;细度增大时,浸出率降低 C6H12O6+12MnO2+24H+==12Mn2++6CO2↑+18H2O [Ag(CN)2]- +e-==Ag+2CN- NaCN、O2 向过滤器中加冰水(或蒸溜水),至恰好浸没沉淀,待水自然流尽,重复以上操作23次 氨水
【解析】(1)操作1与操作2均为将不溶固体从溶液中分离出来,应选择过滤操作;
(2) 因纤维细度为0.35 mm时,对生产工艺要求更高,但浸出率提升不明显;纤维细度增大时,浸出率降低,故应控制细度0.5mm较为合适;
(3)纤维素水解生成的单糖为葡萄糖,在酸性条件下葡萄糖被MnO2氧化为CO2,同时溶液中得到Mn2+,根据电子守恒、电荷守恒及原子守恒,得此反应的离子方程式C6H12O6+12MnO2+24H+==12Mn2++6CO2↑+18H2O;
(4)[Ag(CN)2]-在阴极得电子发生还原反应,生成Ag,其电极方程式[Ag(CN)2]- +e-==Ag+2CN-;同时阳极产物为O2,则通过电解得到的NaCN、O2 均可循环使用;
(5)为减小MnSO4·H2O晶体的溶解损失,洗涤时可向过滤器中加冰水,至恰好浸没沉淀,待水自然流尽,重复以上操作23次即可;洗涤液与母液合并,加入盐酸,生成AgCl,利用浓氨水可溶解AgCl得到银氨溶液,再与葡萄糖发生银镜反应获得Ag,故试剂a是氨水。