题目内容
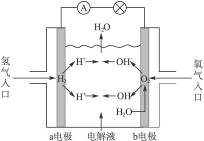
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入H2和O2,下解说法不正确的是( )
| A.通入H2的电极为负极 |
| B.通入O2的一极电极反应为4H2O+O2+8e=8OH- |
| C.随着放电的进行,负极附近pH上升 |
| D.标准状况下通入5.6LO2完全反应后有1mol电子转移 |
C
本题考点是原电池部分的基础知识,要求学会会判断电源的正负极,会正确书写电极反应式和总电池反应式,高考对这一问题会从两个方面进行考查:
1.根据给出的两个电极反应式,写总反应式:书写时注意使两个电极反应式得失电子数相等后相加两式,消去反应物和生成物中相同的物质即可。注意若反应式同侧出现不共存的离子,如H+和OH-,Pb2-和SO42-,要写成反应后的物质如H2O和PbSO4。
2.给出总反应式,写电极反应式:
书写步骤为:1)列物质,标得失 2)选离了配电荷,3)配个数,巧用水,4)两式加验总式以氢氧燃料电池为例。已知总电池反应为2H2+O2=2H2O。电解质溶液为KOH溶液,试写出两极反应式。
负极书写步骤为:
1)根据总电池方程式列出总式两边化合价升高的有关物质,标出失去电子的数目:
2H2-4e→2H2O
2)根据电解质溶液的酸碱性,用H+或OH-或其他离子配平,使反应式两边电荷总数相等。
2H2+4OH--4e——2H2O
此时注意:①电子带负电,②在碱性电解质溶液中,电极反应式不宜出现H+,如上式写成2H2-2e——2H2O+4H+就不对了。③上式亦不能写成:2H2-4e——2H2O-4OH-,因为H2失电子,不可能出现OH-。
3)利用H2O使两边元素守恒,即 2H2+4OH--4e=4H2O
同理:正极电极反应式书写如下:
1),2)O2+4e——4OH-
3)O2+2H2O+4e=4OH-
4)将正负极电极方程式相加,若得到总反应式,说明写法正确。
1.根据给出的两个电极反应式,写总反应式:书写时注意使两个电极反应式得失电子数相等后相加两式,消去反应物和生成物中相同的物质即可。注意若反应式同侧出现不共存的离子,如H+和OH-,Pb2-和SO42-,要写成反应后的物质如H2O和PbSO4。
2.给出总反应式,写电极反应式:
书写步骤为:1)列物质,标得失 2)选离了配电荷,3)配个数,巧用水,4)两式加验总式以氢氧燃料电池为例。已知总电池反应为2H2+O2=2H2O。电解质溶液为KOH溶液,试写出两极反应式。
负极书写步骤为:
1)根据总电池方程式列出总式两边化合价升高的有关物质,标出失去电子的数目:
2H2-4e→2H2O
2)根据电解质溶液的酸碱性,用H+或OH-或其他离子配平,使反应式两边电荷总数相等。
2H2+4OH--4e——2H2O
此时注意:①电子带负电,②在碱性电解质溶液中,电极反应式不宜出现H+,如上式写成2H2-2e——2H2O+4H+就不对了。③上式亦不能写成:2H2-4e——2H2O-4OH-,因为H2失电子,不可能出现OH-。
3)利用H2O使两边元素守恒,即 2H2+4OH--4e=4H2O
同理:正极电极反应式书写如下:
1),2)O2+4e——4OH-
3)O2+2H2O+4e=4OH-
4)将正负极电极方程式相加,若得到总反应式,说明写法正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Cd+2NiO(OH)+2H2O。由此可见,该电池的负极材料是( )
Cd+2NiO(OH)+2H2O。由此可见,该电池的负极材料是( )
 .BaCl2 + H2SO4 = BaSO4↓+ 2HCl △H < 0
.BaCl2 + H2SO4 = BaSO4↓+ 2HCl △H < 0 0
0