题目内容
【题目】水溶液X中可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:
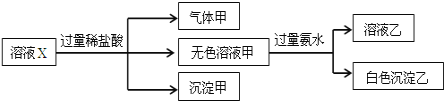
下列判断不正确的是( )
A.气体甲可能是混合物
B.沉淀甲是硅酸和硅酸镁的混合物
C.白色沉淀乙的主要成分是氢氧化铝
D.K+、[Al(OH)4]-和SiO32-一定存在于溶液X中
【答案】B
【解析】
溶液X中进入过量盐酸,生成的气体甲,气体甲可能为二氧化碳或者二氧化硫,原溶液中可能存在SO32-、CO32-,溶液中一定不存在Mg2+、Al3+,再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,根据题干的离子可知,溶液中一定存在SiO32-,沉淀甲为硅酸;
无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在[Al(OH)4]-,白色沉淀乙为氢氧化铝;
根据以上分析进行判断。
溶液X中进入过量盐酸,生成的气体甲可能为二氧化碳或者二氧化硫,原溶液中可能存在SO32-、CO32-,根据离子共存可知,原溶液中一定不存在Mg2+、Al3+,结合溶液电中性可知,原溶液中一定存在K+;由于加入盐酸生成了沉淀甲,根据题干中的离子可知,远溶液中一定存在SiO32-,沉淀甲为硅酸;无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在[Al(OH)4]-,白色沉淀乙为氢氧化铝;
A.根据以上分析可知,气体甲可能为二氧化碳和二氧化硫的混合物,故A正确;
B.由于加入的盐酸过量,生成的沉淀甲为硅酸,不会含有硅酸镁,故B错误;
C.根据分析可知,原溶液中可能存在SO32-、CO32-,根据离子共存可知,原溶液中一定不存在Mg2+、Al3+,而溶液甲中加入过量氨水生成了沉淀乙,沉淀乙只能为氢氧化铝,原溶液中的[Al(OH)4]-与过量酸反应生成铝离子,故C正确;
D.根据以上分析可知,原溶液中一定存在K+、[Al(OH)4]-和SiO32-,故D正确;
故答案为B。

【题目】除去下列物质中所含的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
选项 | 混合物 | 试剂 | 分离方法 |
A | 溴苯(溴) |
| 分液 |
B | 乙醇(水) |
| 过滤 |
C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 乙酸乙酯(乙酸) |
| 分液 |
A.AB.BC.CD.D