题目内容
6.如图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去).请根据要求完成下列各题.
(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应.所选装置的顺序依次为(从左向右)ADBEC;
(2)写出A中反应的离子方程式并用双线桥法表示反应中电子转移的方向和数目
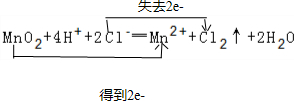 ;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.
;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.(3)E管中现象剧烈燃烧,产生棕黄色烟;脱脂棉的作用是防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管.
分析 (1)制备气体的一般顺序为:发生装置,除杂、干燥装置,检验性质,尾气吸收装置;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;反应中锰元素化合价从+4价降为+2价,氯化氢氯元素从-1价升高为氯气中的0价,反应1mol二氧化锰,消耗4mol氯化氢,生成1mol氯气,其中被氧化的氯化氢物质的量为2mol,转移电子2mol;
(3)铜在氯气燃烧生成氯化铜沉淀;脱脂棉的作用是防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管.
解答 解:(1)实验室用A装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶C和盛有浓硫酸的洗气瓶B,除杂干燥后通入装置E检验氯气和铜的反应,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置C吸收,所以正确的顺序为:ADBEC;
故答案为:ADBEC;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,离子方程式:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;反应中锰元素化合价从+4价降为+2价,氯化氢氯元素从-1价升高为氯气中的0价,用双线去桥表示为: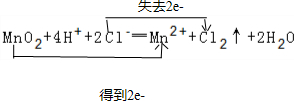 ;
;
反应1mol二氧化锰,消耗4mol氯化氢,生成1mol氯气,其中被氧化的氯化氢物质的量为2mol,转移电子2mol,则若在标准状态下收集到2.24L氯气,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,被氧化的HCl的物质的量是0.2mol;
故答案为: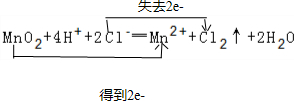 ;0.2;
;0.2;
(3)铜在氯气的环境中剧烈燃烧,产生棕黄色的氯化铜颗粒,固体颗粒为烟,脱脂棉的作用是防止固体冲出,阻塞导管,
故答案为:剧烈燃烧,产生棕黄色烟;防止固体冲出,阻塞导管.
点评 本题考查了氯气的实验室制法和氯气的性质,氧化还原反应的规律,明确氯气制备原理的氯气性质是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案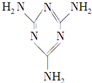 三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )
三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )| A. | 三聚氰胺是一种蛋白质 | B. | 三聚氰胺不是高分子化合物 | ||
| C. | 三聚氰胺分子中含有碳碳双键 | D. | 三聚氰胺的分子式为C3H6N6 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1=25% | α2 | α3 |
(2)该温度下,丙中反应2NH3?N2+3H2的平衡常数是34.17.
(3)a+b=92.4(填“<”、“>”或“=”,下同);α1+α3<1.
(4)若要使甲重新达平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小,其他条件可采用BC.
A.使用催化剂 B.增大氮气浓度C.升高温度 D.缩小容器体积.
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )| A. | 镁和铝消耗硫酸的物质的量之比是2:3 | |
| B. | 参加反应的镁、铝的质量之比是8:9 | |
| C. | 反应中消耗的镁、铝的物质的量之比是3:2 | |
| D. | 反应中镁、铝转移电子的物质的量之比是2:3 |
| A. | 含有5mol电子 | B. | 含有10mol电子 | ||
| C. | 含有5mol中子 | D. | 含有4mol共用电子对 |

